Синтез фенолоальдегидных полимеров: особенности процессов поликонденсации
В результате взаимодействия фенола с альдегидами образуются олигомеры и полимеры, строение которых зависит от:
- функциональности использованного фенола,
- типа альдегида,
- мольного соотношения реагентов,
- рН реакционной среды.
При этом образуются либо линейные (или слабо разветвленные) термопластичные продукты, которые называются новолаками, либо сильно разветвленные термореактивные олигомеры, названные резолами.
В фенолах реакционноспособными являются атомы водорода, находящиеся в орто- и пара-положениях к гидроксильной группе. Поэтому из одноатомных фенолов трифункциональными являются фенол, м-крезол и 3,5-ксиленол, а из двухатомных— резорцин: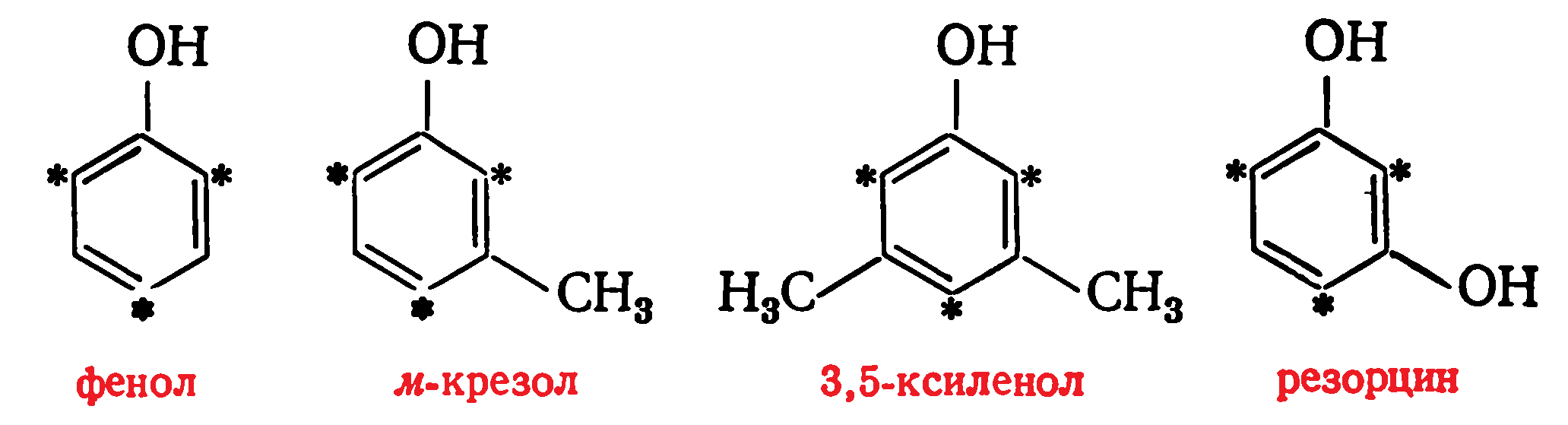
К бифункциональным относятся фенолы с заместителем в орто- или пара-положении— о- и п-крезолы 2,3-, 2,5- и 3,4-ксиленолы: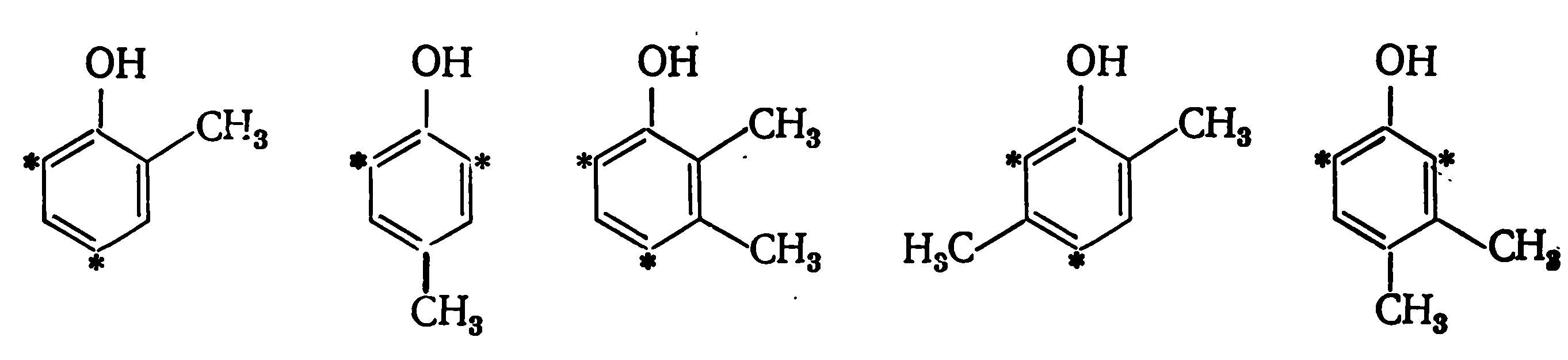 2,6- и 2,4-ксиленолы — монофункциональны.
2,6- и 2,4-ксиленолы — монофункциональны.
При поликонденсации формальдегида и фурфурола с трифункциональными фенолами могут получаться как термопластичные, так и термореактивные олигомеры. Бифункциональные фенолы образуют только термопластичные олигомеры.
Из альдегидов лишь формальдегид и фурфурол способны образовывать термореактивные олигомеры при поликонденсации с трифункциональными фенолами. Другие альдегиды (уксусный, масляный и т. д.) вследствие пониженной химической активности и пространственных затруднений не образуют термореактивных олигомеров.
Термопластичные (новолачные) олигомеры образуются в следующих случаях:
- при избытке фенола (соотношение фенол : формальдегид 1 : 0,78—0,86) в присутствии кислотных катализаторов; при отсутствии избытка фенола образуются резольные олигомеры;
- при большом избытке формальдегида (соотношение фенол : формальдегид 1 : 2—2,5) в присутствии сильных кислот в качестве катализатора; получаемые в этом случае олигомеры не отверждаются при нагревании, но при добавлении к ним небольшого количества оснований переходят в неплавкое и нерастворимое состояние.
Термореактивные (резольные) олигомеры образуются в следующих случаях:
- при поликонденсации избытка трифункционального фенола с формальдегидом в присутствии основных катализаторов (в щелочной среде термореактивные олигомеры получаются даже при очень большом избытке фенола, который в этом случае остается растворенным в продукте реакции);
- при небольшом избытке формальдегида в присутствии как основных, так и кислотных катализаторов.
Особенностью взаимодействия фенолов с формальдегидом является использование формальдегида главным образом в виде водных растворов. Такой раствор имеет сложный состав вследствие протекания следующих обратимых реакций:
СН2О + Н2О <=> НОСН2ОН
НО(СН2О)nН + НОСН2ОН <=> НО(СН2О)n+1Н + Н20
НО(СН2О)nН + СН3ОН <=> СН3О(СН2О)nН + Н20
В реакции с фенолом участвует наиболее реакционноспособный свободный формальдегид, концентрация которого в растворе мала. По мере расходования формальдегида происходит смещение равновесия влево. При этом скорость образования формальдегида выше скорости его расходования на реакцию с фенолом. Поэтому в процессе взаимодействия фенола с формальдегидом стадии дегидратаций метиленгликоля, деполимеризации олигооксиметиленгликолей и разложения полуацеталей не являются лимитирующими.
Кинетика и механизм процесса образования фенолоформальдегидных олигомеров определяются типом используемого катализатора. В присутствии кислот реакция протекает следующим образом: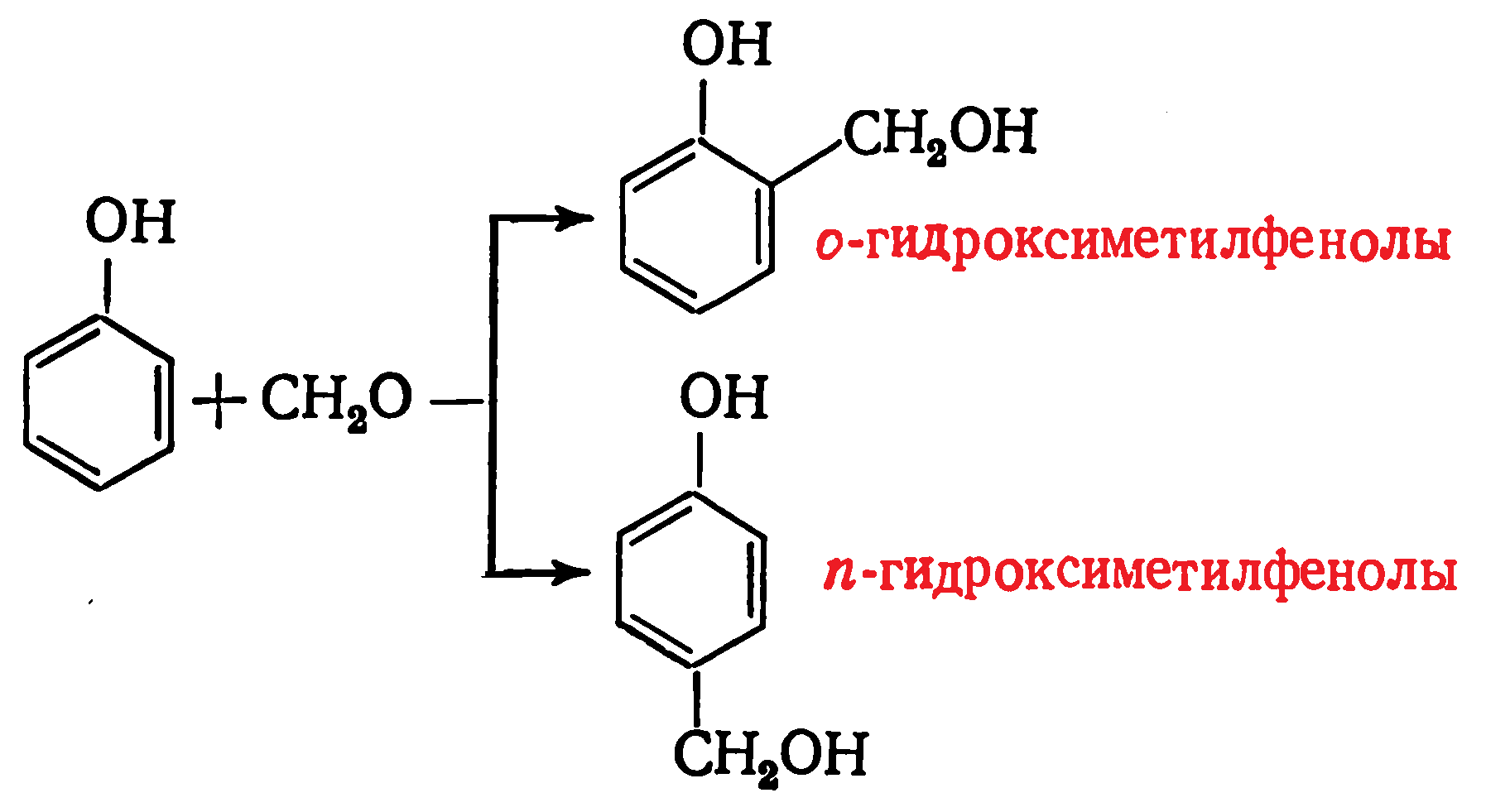 Вначале эти соединения образуются примерно в равных количествах, затем вследствие более высокой реакционной способности доля пара-изомера становится меньше. Суммарное содержание моногидроксиметилфенолов в реакционной среде вначале возрастает, достигая 6—8%, а затем начинает снижаться, поскольку скорость реакций присоединения почти на порядок ниже скорости реакций конденсации.
Вначале эти соединения образуются примерно в равных количествах, затем вследствие более высокой реакционной способности доля пара-изомера становится меньше. Суммарное содержание моногидроксиметилфенолов в реакционной среде вначале возрастает, достигая 6—8%, а затем начинает снижаться, поскольку скорость реакций присоединения почти на порядок ниже скорости реакций конденсации.
По мере протекания конденсации образуются 4,4′- и 2,4′-дигидроксидифенилметаны, а затем в меньшем количестве 2,2′-дигидроксидифенилметан: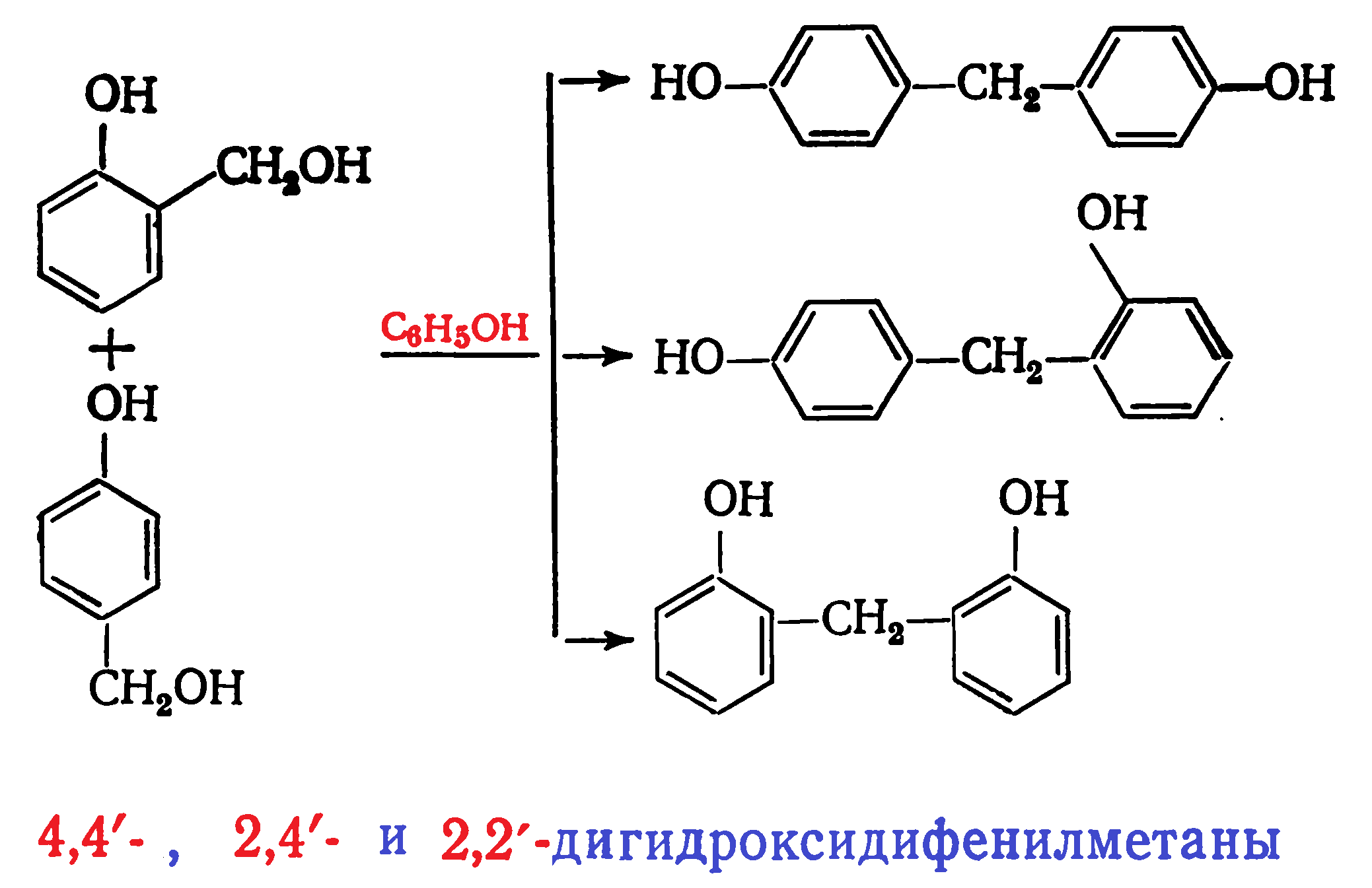 В продуктах реакции на начальной стадии конденсации обнаружены также 1,3-бензодиоксан и полуацетальные производные гидроксиметилфенолов. При этом в продуктах поликонденсации почти отсутствуют ди- и тригидроксиметилфенолы и дигидроксидибензиловые эфиры. Последние образуются при взаимодействии гидроксиметильных производных фенола друг с другом:
В продуктах реакции на начальной стадии конденсации обнаружены также 1,3-бензодиоксан и полуацетальные производные гидроксиметилфенолов. При этом в продуктах поликонденсации почти отсутствуют ди- и тригидроксиметилфенолы и дигидроксидибензиловые эфиры. Последние образуются при взаимодействии гидроксиметильных производных фенола друг с другом: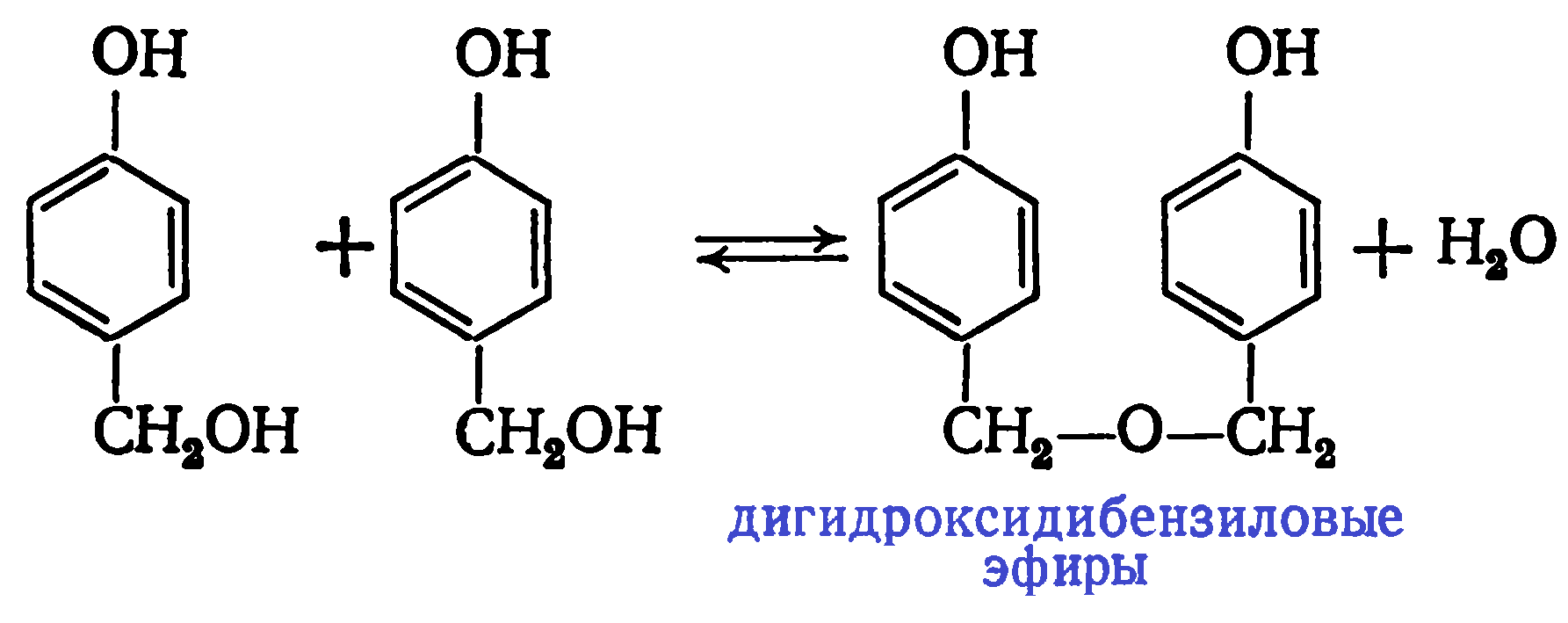 Малая концентрация этих соединений в реакционной массе объясняется их низкой стойкостью. Дигидроксидибензиловые эфиры разлагаются с выделением формальдегида:
Малая концентрация этих соединений в реакционной массе объясняется их низкой стойкостью. Дигидроксидибензиловые эфиры разлагаются с выделением формальдегида: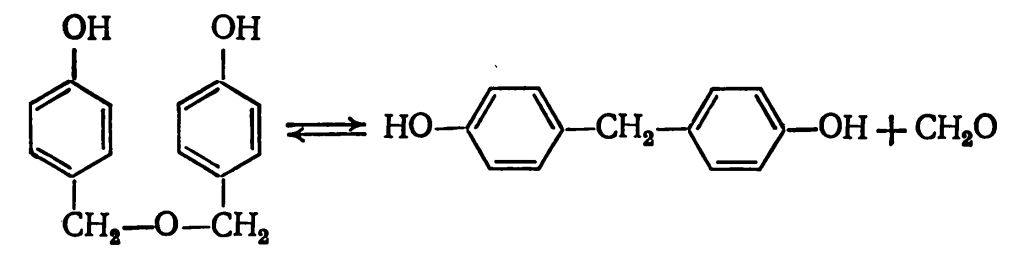
Кроме того возможен фенолиз дигидроксидибензиловых эфиров (К=2·1010 при 25 °С), в результате которого образуется смесь продуктов, содержащая о-гидроксиметилфенол, 2,2′- и 2,4′-дигидроксидифенилметаны, а также трех- и четырехядерные мономеры с метиленовыми связями. Ниже приведены данные о константах равновесия этих реакций:
| Реакция | Константа равновесия | |
| при 25 °С | при 100 °С | |
| Образование гидроксиметилфенолов | 8·103 | 102 |
| Образование дигидроксидифенилметанов | 109 | 3·106 |
| Образование дигидроксидибензиловых эфиров | 8·10-2 | 9·10-3 |
| Разрушение диметиленэфирной связи | 2·106 | 5·106 |
Как видно из значений констант равновесия, образование метиленового мостика между фенильными ядрами термодинамически намного выгоднее, чем мостика —СН2ОСН2— (соответствующие константы равновесия различаются на 8—9 порядков). В обычных условиях синтеза фенолоформальдегидных олигомеров, при использовании формальдегида в виде водных растворов, образование дигидроксидибензиловых эфиров практически невозможно.
При использовании орто-замещенных производных фенола соответствующие орточизомеры дополнительно стабилизируются за счет образования внутримолекулярной водородной связи: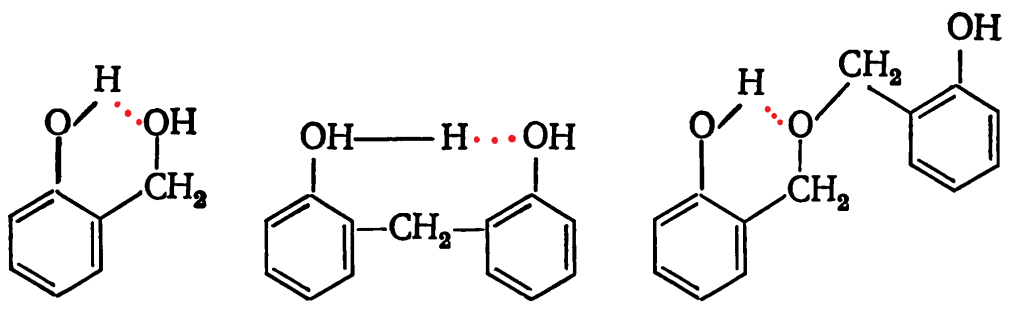 На последующих стадиях химического процесса происходит взаимодействие моногидроксиметильных производных фенола с дигидроксидифенилметанами. Реакции присоединения и конденсации, протекающие в кислой среде, имеют первый порядок по каждому из реагентов, в константы скорости — прямо пропорциональны активности ионов водорода. Энергии активации реакций присоединения 78,6—134,0 кДж/моль, реакции конденсации фенола с о-гидроксиметилфенолом 77,5—95,8 кДж/моль и n-гидроксиметилфенолом 57,4—79,2 кДж/моль.
На последующих стадиях химического процесса происходит взаимодействие моногидроксиметильных производных фенола с дигидроксидифенилметанами. Реакции присоединения и конденсации, протекающие в кислой среде, имеют первый порядок по каждому из реагентов, в константы скорости — прямо пропорциональны активности ионов водорода. Энергии активации реакций присоединения 78,6—134,0 кДж/моль, реакции конденсации фенола с о-гидроксиметилфенолом 77,5—95,8 кДж/моль и n-гидроксиметилфенолом 57,4—79,2 кДж/моль.
Скорость реакций присоединения и конденсации по незамещенным орто-положениям новолачного олигомера мало зависит от молекулярной массы, т. е. все свободные орто-положения имеют равную реакционную способность.
Увеличение конверсии мономеров приводит к разделению реакционной массы на два слоя: водный и олигомерный, после чего реакция продолжается в гетерогенной системе. Взаимодействие на границе раздела фаз практически не имеет значения ввиду относительно медленного протекания рассматриваемых реакций.
Наличие в феноле трех реакционноспособных групп создает предпосылки для изомерии фенолоформальдегидных олигомеров. Их изомерный состав определяется соотношением скоростей реакций по о- и п–положениям фенольных ядер. Реакционная способность этих положений зависит от природы катализатора, pH среды и температуры.
В условиях, обычных для получения новолачных (катализатор – кислота, pH=0-2, 37%-ный раствор форалина, температура около 100 °С) незамещенные пара-положения фенольных звеньев и пара-гидроксиметильные группы значительно активнее соответствующих орто-положений и орто- гидроксиметильных групп. Это различие особенно значительно в случае реакции конденсации, что видно из данных, приведенных ниже:
| Реакции | Константа скорости,
k·105 с-1 |
Энергия активации,
кДж/моль |
| Фенол —> о-гидроксиметилфенол | 1,5 | 93,5 |
| Фенол —> п-гидроксиметилфенол | 1,8 | 79,6 |
| о-Гидроксиметилфенол —>
2,2′-дигидроксидифенилметан |
5,9 | 96,0 |
| п-Гидроксиметилфенол —>
2,4′-дигидроксидифенилметан |
35,6 | 79,3 |
| о-Гидроксиметилфенол —>
2,4′-дигидроксидифенилметан |
14,8 | 78,0 |
| п-Гидроксиметилфенол —>
4,4′-дигидроксидифенилметан |
83,9 | 72,5 |
Скорость реакций по орто-положениям возрастает с увеличением рН и температуры. Изомерный состав продуктов поликонденсации в водном растворе мало зависит от природы кислоты. В случае проведения поликонденсации в органических растворителях (этиловый спирт, толуол, тетрахлорэтан) доля орто-замещения снижается в ряду кислот: уксусная >щавелевая >бензолсульфокислота> соляная.
В обычных новолаках содержится 50—60% орто-, пара-метиленовых связей, 10— 25% орто-, орто- и 25—30% пара-, пара-метиленовых связей.
В процессе получения фенольных олигомеров образуются линейные и разветвленные продукты. Однако степень разветвленности невелика, так как доля тризамещенных фенольных звеньев составляет 10—15%. Малая степень разветвленности объясняется тем, что исходная смесь изомеров содержит избыток фенола.
Поликонденсация в кислой среде
При кислотном катализе реакция протекает по следующему механизму. Сначала происходит протонизация формальдегида:![]()
Далее возникший карбониевый ион атакует фенол, образуя ион гидроксиметилфенола: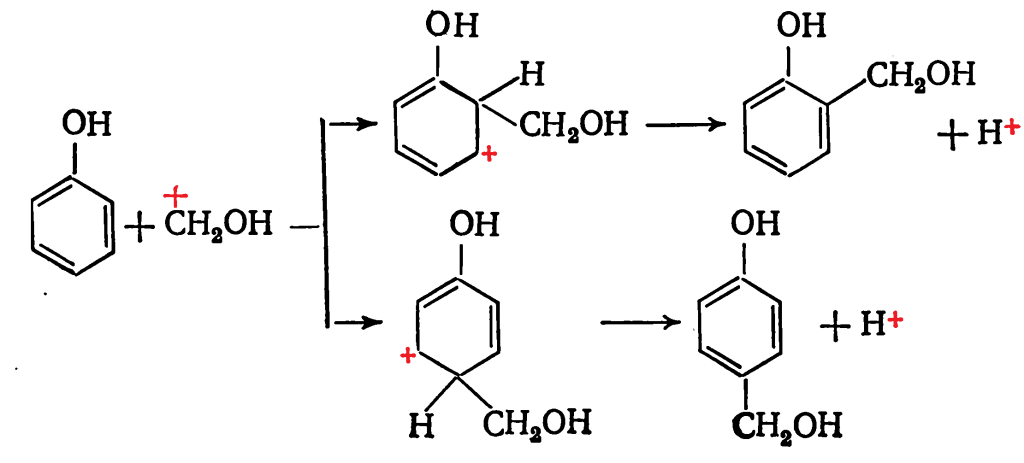 В кислой среде гидроксиметилфенолы образуют сравнительно устойчивые и долгоживущие карбониевые ионы, которые реагируют как электрофильные агенты с фенолом или его гидроксиметильными производными:
В кислой среде гидроксиметилфенолы образуют сравнительно устойчивые и долгоживущие карбониевые ионы, которые реагируют как электрофильные агенты с фенолом или его гидроксиметильными производными: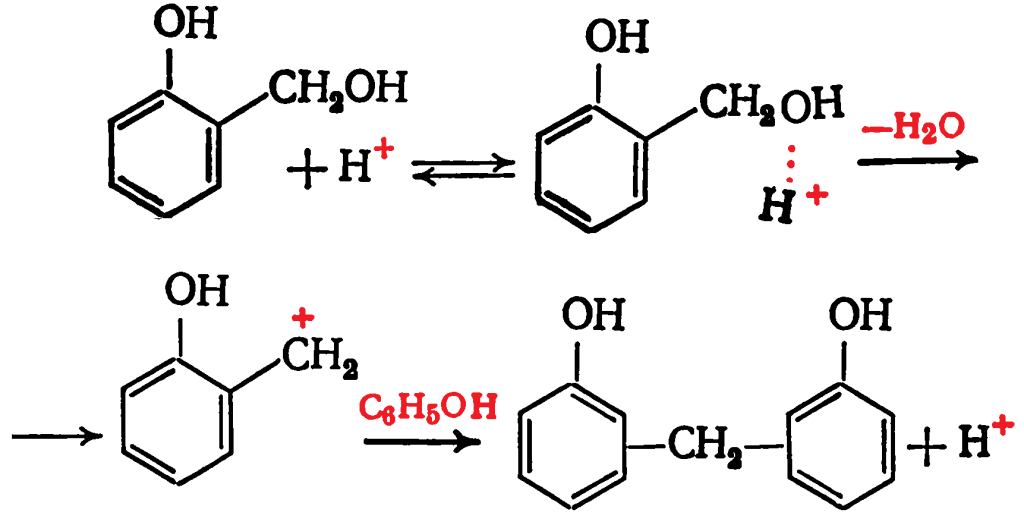 В общем виде процесс получения новолака может быть представлен схемой:
В общем виде процесс получения новолака может быть представлен схемой:![]() Уменьшение избытка фенола в исходной смеси сопровождается возрастанием молекулярной массы образующегося новолака, и при соотношении, близком к эквимольному, можно получить полимер пространственного строения.
Уменьшение избытка фенола в исходной смеси сопровождается возрастанием молекулярной массы образующегося новолака, и при соотношении, близком к эквимольному, можно получить полимер пространственного строения.
В молекулах новолаков, полученных из трифункционального фенола или смеси фенолов, содержащей хотя бы один трифункциональный фенол, еще остаются активные атомы водорода в орто- и пара – положениях к фенольным гидроксилам. Поэтому при обработке их формальдегидом заменив кислотный катализатор основным, можно получить резол непосредственно неплавкий и нерастворимый полимер резит.
Резит получается также при действии на новолак полимеров формальдегида (параформ, α-полиоксиметилен, β-полиоксиметилен) или гексаметилентетрамина. В последнем случае, по-видимому, в процессе отверждения участвуют ди- и триметиламины, образующиеся при разложении гексаметилентетрамина, а выделяющийся аммиак играет роль катализатора.
Новолаки, полученные из бифункциональных фенолов (о- и п-крезолов), при обработке формальдегидом не переходят в неплавкое и нерастворимое состояние. Однако если такие олигомеры нагревать выше 180 °С, они способны переходить, хотя и медленно, в неплавкое и нерастворимое состояние.
Аналогичная картина наблюдается при 250—280 °С и для новолаков, получаемых поликонденсацией 1 моль фенола с 0,8 моль формальдегида, что можно объяснить активацией атомов водорода в мета-положении к фенольным гидроксилам или взаимодействием последних с образованием эфирных связей.
Поликонденсация в щелочной среде
При взаимодействии фенола, с формальдегидом в щелочной среде так же, как и в случае кислотного катализа, сначала образуются о- и п-гидроксиметилфенолы, затем 2,4- и 2,6-дигидроксиметилфенолы и, наконец, тригидроксиметилфенолы. В поликонденсании, преимущественно участвуют пара-гидроксиметильные группы и незамещенные пара-положения фенольных ядер.
Из гидроксиметильных производных наиболее реакционноспособным является 2,6-дигидрокоимеилфенол, который быстро реагирует с формальдегидом с образованием тригидроксиметилфенола. Образующиеся в щелочной среде гидроксиметилфенолы (в отличие от кислой) весьма устойчивы. Поэтому при температуре реакции не выше 60 °С гидрокеиметилфенолы остаются практически единственными продуктами реакции.
С повышением температуры гидроксиметилпроизводные начинают взаимодействовать как между собой, так и с фенолом. Основным продуктом при гомоконденсации п-гидроксиметилфенола является 5-гидроксиметил-2,4′-дигидроксидифенилметан: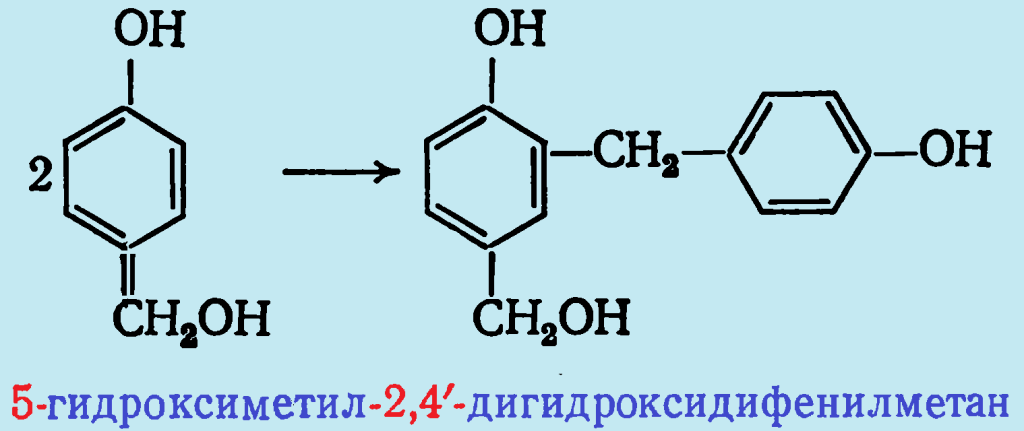 При этом по аналогии с кислотным катализом также происходит образование 4,4′-дигидроксидифенилметана. Однако, поскольку это соединение обнаружено и в отсутствие фенола, реакция, по-видимому протекает через промежуточное образование неустойчивого дигидроксидибензилового эфира:
При этом по аналогии с кислотным катализом также происходит образование 4,4′-дигидроксидифенилметана. Однако, поскольку это соединение обнаружено и в отсутствие фенола, реакция, по-видимому протекает через промежуточное образование неустойчивого дигидроксидибензилового эфира: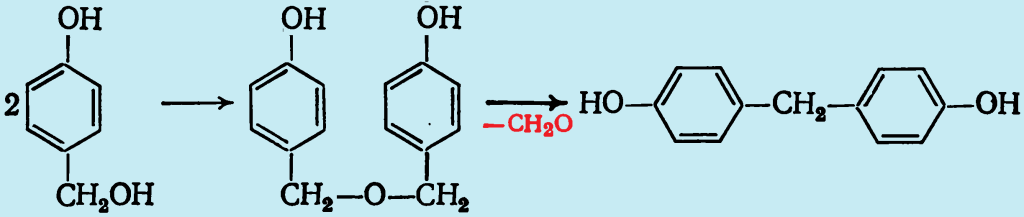
Следует отметить, что в щелочной среде вообще устойчивые соединения с диметиленэфирной связью
—СН2ОСН2—
в заметных количествах не образуются. Соотношение паpa- и орто-замещенных гидроксиметилфенолов зависит от с уменьшением рН доля пара-замещённых продуктов уменьшается (при рН=13 оно составляет 0,38, при рН=8,7 оно равно 1,1).
В зависимости от использованного щелочного катализатора в ряду катионов это соотношение увеличивается в следующей последовательности:
Mg<Ca<Sr<Ba<Li<Na
При рН≤9 реакции присоединения имеют первый порядок по фенолу и формальдегиду, скорость их прямо пропорциональна концентрации ОН– -ионов. Для катализа NaOH при 57 °С и рН≈8,3 получены следующие значения констант скорости и энергии активации:
| Реакции | Константа скорости, k·105, л·моль/с | Энергия активации, кДж/моль |
| Фенол —> о-гидроксиметилфенол | 1,45 | 68,55 |
| Фенол —> п-гидроксиметилфенол | 0,78 | 65,20 |
| о-Гидроксиметилфенол —>
2,6′-дигидроксиметилфенол |
1,35 | 67,71 |
| о-Гидроксиметилфенол —>
2,4′-дигидроксиметилфенол |
1,02 | 60,61 |
| п-Гидроксиметилфенол —>
2,4′-дигидроксиметилфенол |
1,35 | 77,23 |
| п-Гидроксиметилфенол —>
4,4′-дигидроксиметилфенол |
83,9 | 72,5 |
| 2,6-Дигидроксиметилфенол —>
2,4,6-тригидроксиметилфенол |
2,13 | 58,40 |
| 2,4-Дигидроксиметилфенол —>
2,4,6-тригидроксиметилфенол |
0,84 | 60,19 |
Таким образом, взаимодействие гидроксиметильных производных между собой происходит быстрее, чем их реакции с фенолом.
Механизм взаимодействия фенола с формальдегидом в условиях основного катализа включает образованание анионов псевдокислоты с высокой нуклеофильностью: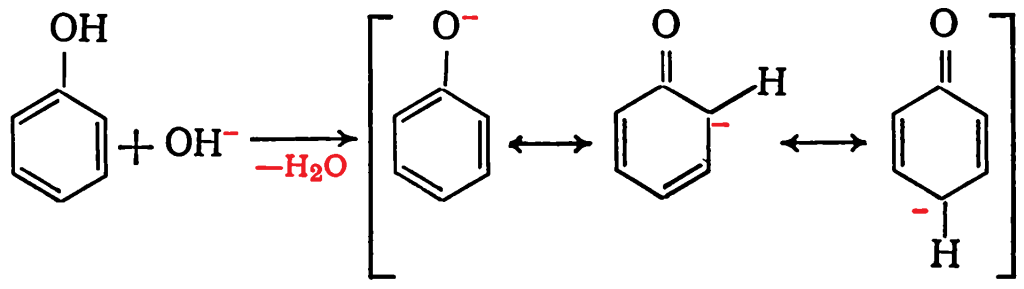 Локализация отрицательного заряда в орто- и пара-положениях псевдокислоты делает их высокореакционноспособными по отношению к электрофильным агентам, в частности к формальдегиду:
Локализация отрицательного заряда в орто- и пара-положениях псевдокислоты делает их высокореакционноспособными по отношению к электрофильным агентам, в частности к формальдегиду: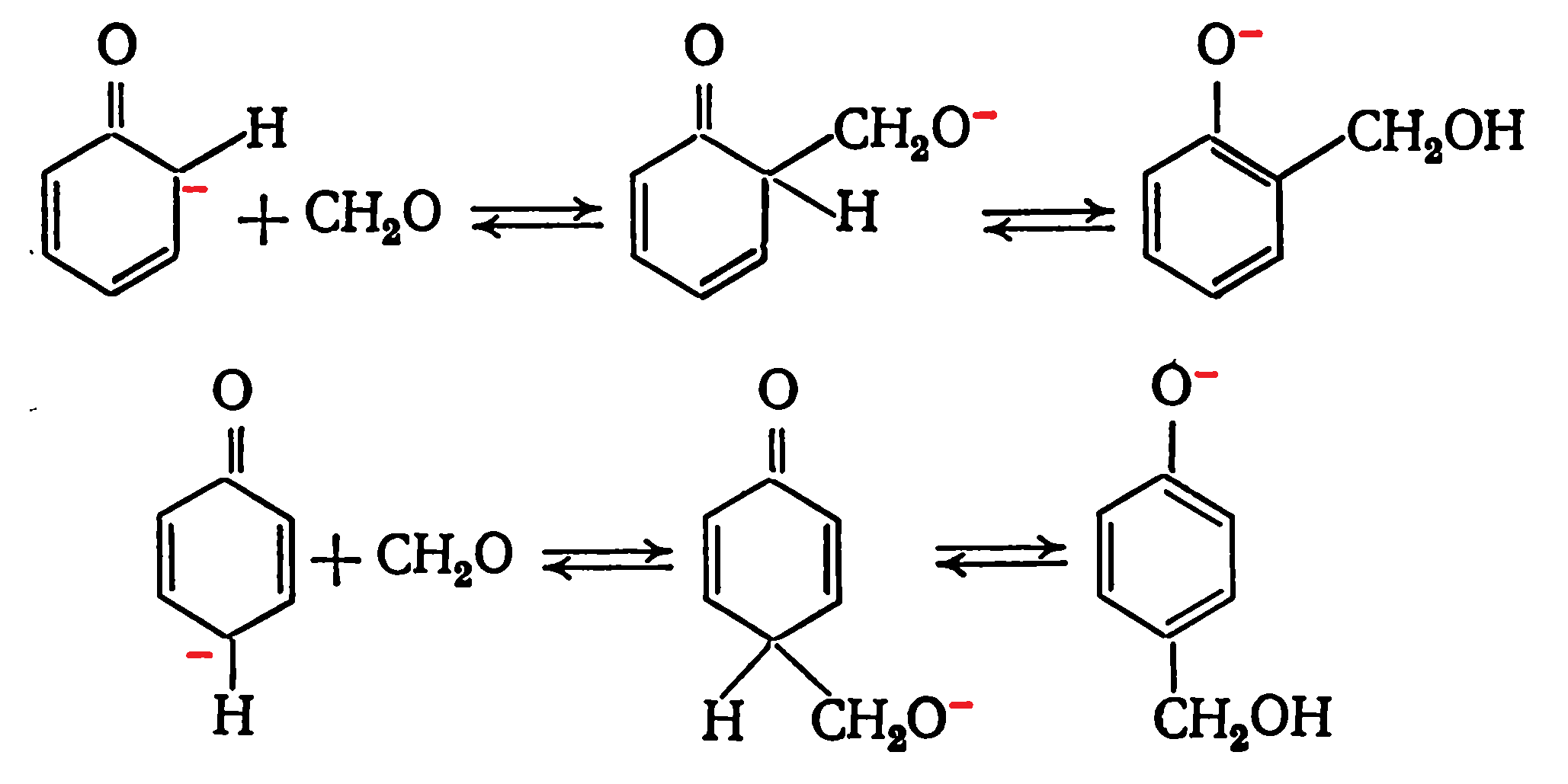 Отрицательный заряд в фенолят-ионе смещается к кольцу за счет индуктивного влияния и эффекта сопряжения. При этом электронная плотность в орто- и пара-положениях повышается в большей степени, чем на кислороде гадроксиметильной группы, так как передача заряда через π-связи более эффективна, чем через δ-связи. Поэтому орто- и пара-положения ядра обладают большей нуклеофильностью, чем гидроксиметильная группа.
Отрицательный заряд в фенолят-ионе смещается к кольцу за счет индуктивного влияния и эффекта сопряжения. При этом электронная плотность в орто- и пара-положениях повышается в большей степени, чем на кислороде гадроксиметильной группы, так как передача заряда через π-связи более эффективна, чем через δ-связи. Поэтому орто- и пара-положения ядра обладают большей нуклеофильностью, чем гидроксиметильная группа.
Следствием этого является атака электрофильного агента по кольцу, что сопровождается образованием метиленовой связи (а не диметиленэфирной). Скорость реакции максимальна при рН=рКа реагентов и минимальна при рН=4—6. При этих значениях рН резольные олигомеры наиболее стабильны.
Некоторую специфику имеет реакция фенола с формальдегидом при использовании в качестве катализатора аммиака. Аммиак легко количественно реагирует с формальдегидом с образованием гексаметилентетрамина: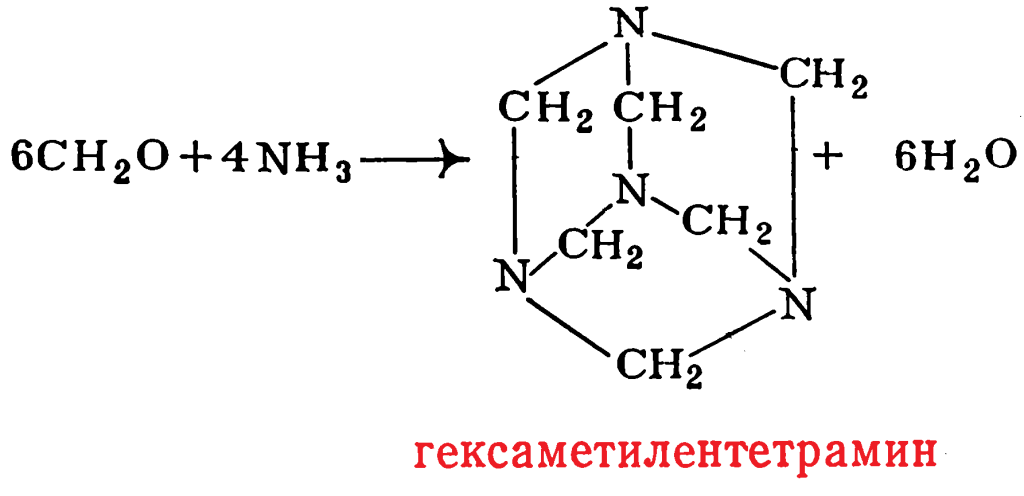 Поэтому, наряду с взаимодействием фенола с формальдегидом может протекать реакция фенола с гексаметилентетраамином. Естественно, что вероятность этой реакции зависит от соотношения СН2О : NH3. Чем оно меньше, тем больше вероятность протекания второй реакции, следствием которой является присутствие в продуктах реакции, наряду с гидроксиметилфенолами, 2-гидроксибензиламина, 2,2′-дигидроксидибензиламина, а также производного бензокоазина строения:
Поэтому, наряду с взаимодействием фенола с формальдегидом может протекать реакция фенола с гексаметилентетраамином. Естественно, что вероятность этой реакции зависит от соотношения СН2О : NH3. Чем оно меньше, тем больше вероятность протекания второй реакции, следствием которой является присутствие в продуктах реакции, наряду с гидроксиметилфенолами, 2-гидроксибензиламина, 2,2′-дигидроксидибензиламина, а также производного бензокоазина строения: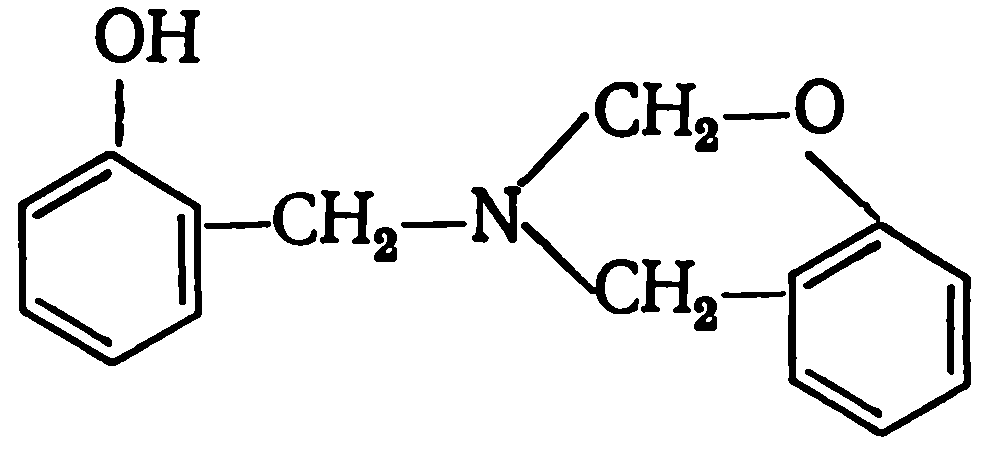 Применение в качестве катализаторов солей, оксидов или гидроксидов металлов приводит в ряде случаев к существенному увеличению доли олигомеров, содержащих орто-замещенные фенольные ядра. Орто-ориентирующим влиянием обладают катионы Zn, Cd, Mg, Са, Sr, Ва, Мn, Со, Ni, Fe, Pb. Орто-ориентирующее влияние указанных катализаторов проявляется особенно заметно при рН = 4—7, когда каталитическое действие ионов Н+ и ОН– минимально. Поэтому в качестве катализаторов чаще всего используют соли слабых карбоновых кислот, например, ацетаты.
Применение в качестве катализаторов солей, оксидов или гидроксидов металлов приводит в ряде случаев к существенному увеличению доли олигомеров, содержащих орто-замещенные фенольные ядра. Орто-ориентирующим влиянием обладают катионы Zn, Cd, Mg, Са, Sr, Ва, Мn, Со, Ni, Fe, Pb. Орто-ориентирующее влияние указанных катализаторов проявляется особенно заметно при рН = 4—7, когда каталитическое действие ионов Н+ и ОН– минимально. Поэтому в качестве катализаторов чаще всего используют соли слабых карбоновых кислот, например, ацетаты.
Образование гидроксиметилфенолов при катализе гидроксидами металлов можно представить следующим образом: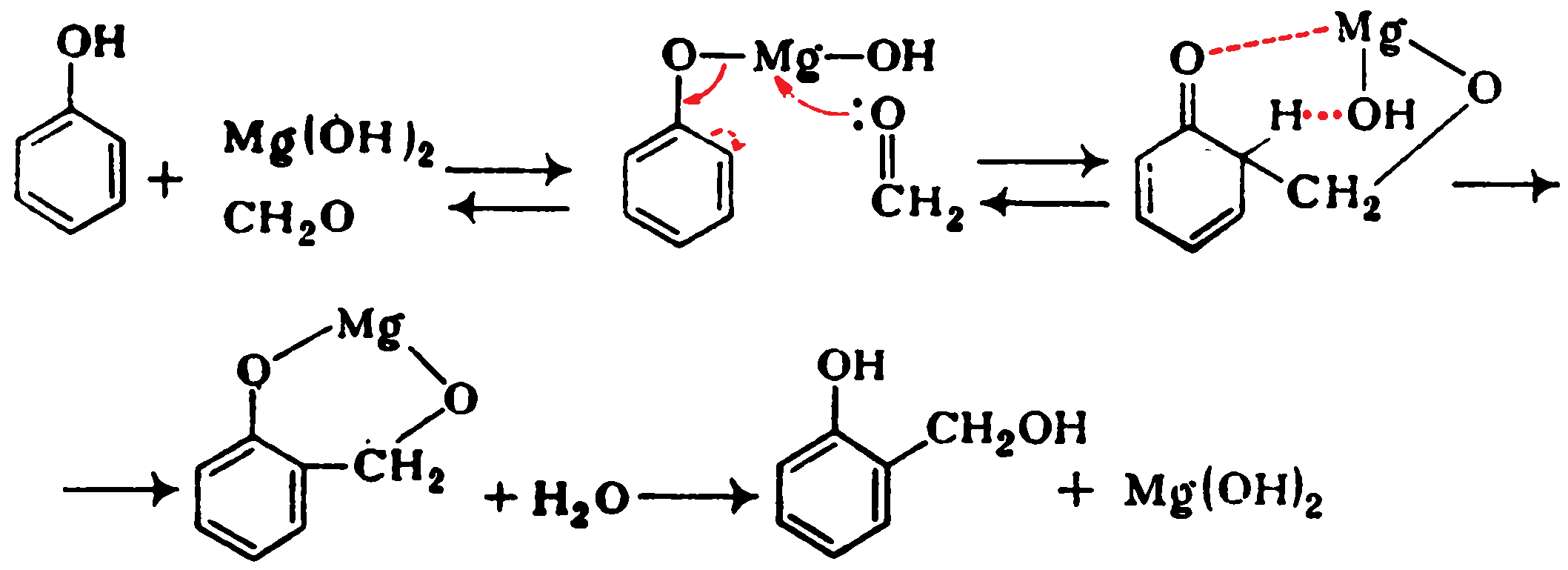 Таким путем можно получать как новолаки, так и резолы. Орто-изомеры преимущественно образуются и в случае некаталитической реакции, для которой предложен механизм, согласно которому реакция идет через Н-комплекс фенол—формальдегид:
Таким путем можно получать как новолаки, так и резолы. Орто-изомеры преимущественно образуются и в случае некаталитической реакции, для которой предложен механизм, согласно которому реакция идет через Н-комплекс фенол—формальдегид: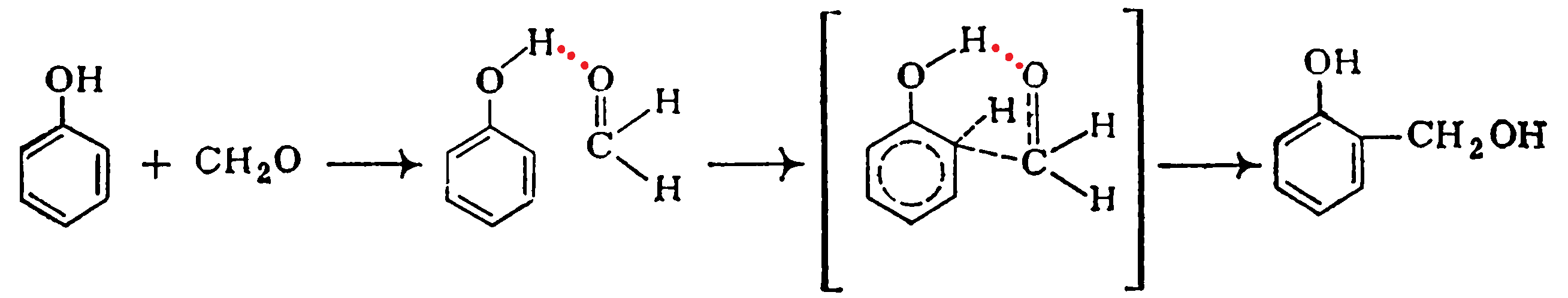 Резолы представляют собой смесь линейных и разветвленных продуктов общей формулы:
Резолы представляют собой смесь линейных и разветвленных продуктов общей формулы:
H-[-C6H2(ОH) (CH2OH)CH2]m-[-C6H3(OH)CH2-]n-OH
где n=2,5, m=4—10.
Молекулярная масса резолов (от 400 до 800—1000) ниже, чем новолачных олигомеров, поскольку для предотвращения гелеобразования поликонденсацию проводят очень быстро. При нагревании резолы постепенно отверждаются, то есть превращаются в полимеры пространственного строения.
В процессе отверждения резольных олигомеров различают три стадии:
- В стадии А, называемой также резольной, олигомер по своим физическим свойствам аналогичен новолачному олигомеру, поскольку так же, как и новолак, он плавится и растворяется в щелочах, спирте и ацетоне. Но в отличие от новолака резол представляет собой нестойкий продукт, который при нагревании переходит в неплавкое и нерастворимое состояние.
- В стадии В полимер, называемый резитолом, лишь частично растворяется в спирте и ацетоне, не плавится, но еще сохраняет способность размягчаться (при нагревании переходить в высокоэластическое, каучукоподобное состояние) и набухать в растворителях.
- В стадии С — конечной стадии отверждения — полимер, называемый резитом, представляет собой неплавкий и нерастворимый продукт, не размягчающийся при нагревании и не набухающий в растворителях.
В стадии резита полимер имеет высокую разнозвенность и очень сложное пространственное строение:
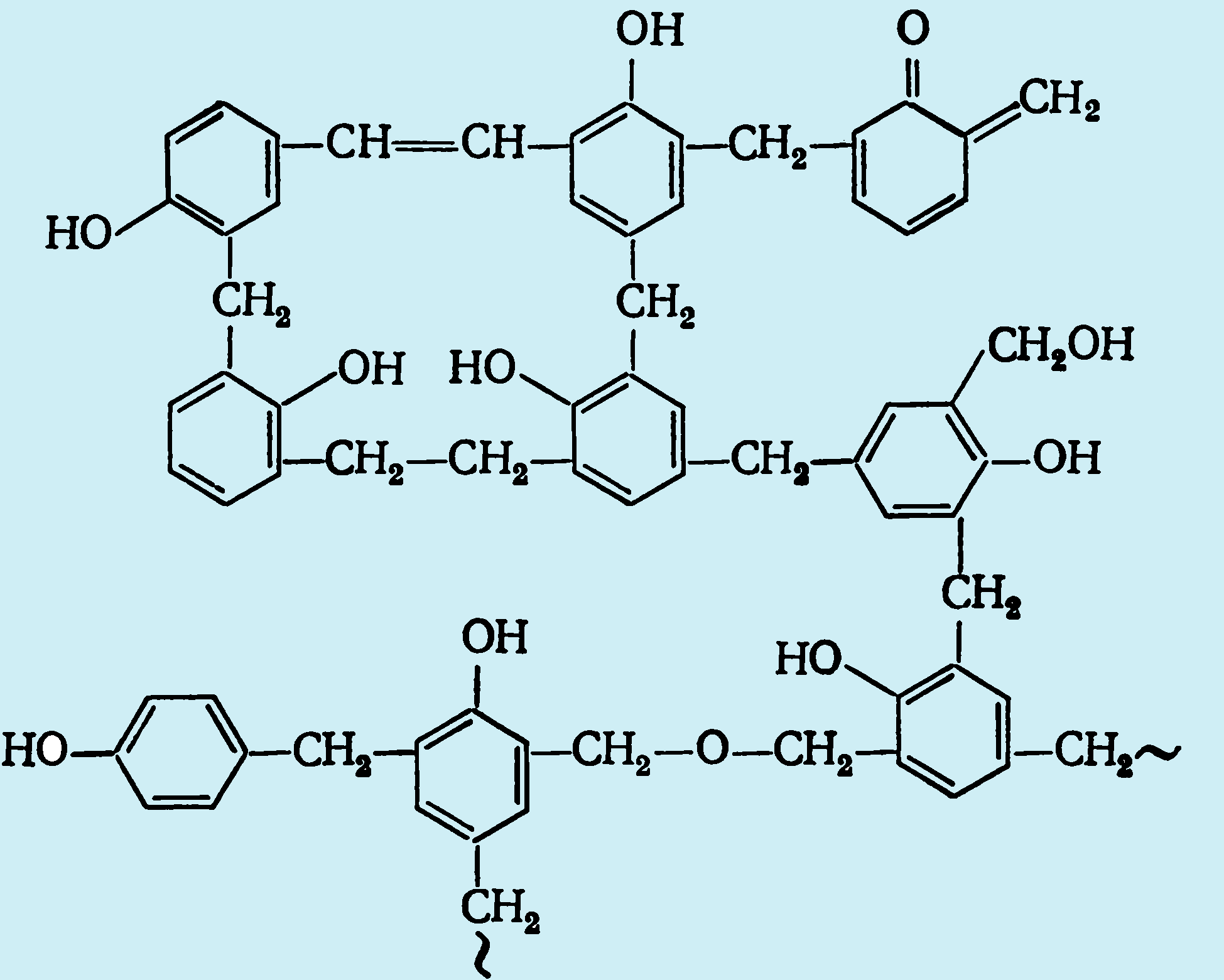
Эта формула показывает лишь содержание определенных групп и группировок, но не отражает их количественного соотношения. В настоящее время считается, что фенолоформальдегидные полимеры являются довольно редко сшитыми (небольшое число узлов в трехмерной сетке). Степень завершенности реакции на последней стадии отверждения невелика. Обычно расходуется до 25% функциональных групп, образующих связи в трехмерной сетке.
Кузнецов Е. В., Прохорова И. П. Альбом технологических схем производства полимеров и пластических масс на их основе. Изд. 2-е. М., Химия, 1975. 74 с.
Кноп А., Шейб В. Фенольные смолы и материалы на их основе. М., Химия, 1983. 279 с.
Бахман А., Мюллер К. Фенопласты. М., Химия, 1978. 288 с.
Николаев А. Ф. Технология пластических масс, Л., Химия, 1977. 366 с.
Автор: Коршак В.В.
Источник: Коршак В.В., Технологии пластических масс, 3-е издание, 1985 год
Дата в источнике: 1985 год
