Этиленоксид
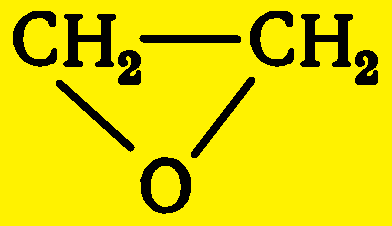 Этиленоксид (окись этилена, оксиран, 1,2-эпоксиэтан) C2H4O — бесцветная жидкость или газ со специфическим запахом, температурой плавления 10,73 °С, температурой замерзания —112,5°С, nD8,4 = 1,360.
Этиленоксид (окись этилена, оксиран, 1,2-эпоксиэтан) C2H4O — бесцветная жидкость или газ со специфическим запахом, температурой плавления 10,73 °С, температурой замерзания —112,5°С, nD8,4 = 1,360.
Этиленоксид получают прямым окислением этилена на серебряноплатиновом катализаторе при 200—300 °С: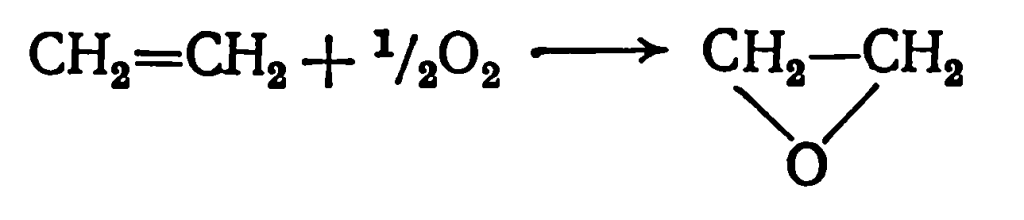 или обработкой этилена хлором с получением этиленхлоргидрина и его последующим дегидрохлорированием:
или обработкой этилена хлором с получением этиленхлоргидрина и его последующим дегидрохлорированием: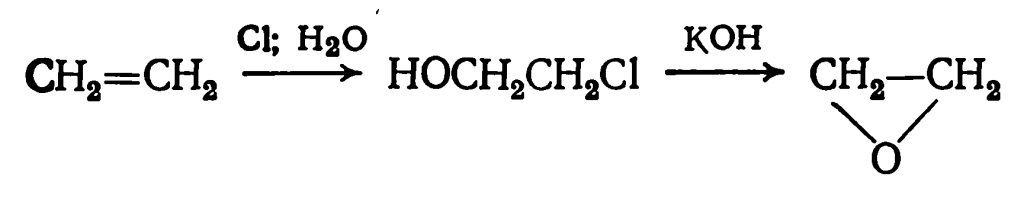 Пары этиленоксида крайне токсичны. Предельно допустимая концентрация его в воздухе 10-6 кг/м3 (1 мг/м3). Жидкий этиленоксид в присутствии влаги вызывает сильные ожоги. Смеси этиленоксида с воздухом взрывоопасны в широких концентрационных пределах —от 3 до 100%.
Пары этиленоксида крайне токсичны. Предельно допустимая концентрация его в воздухе 10-6 кг/м3 (1 мг/м3). Жидкий этиленоксид в присутствии влаги вызывает сильные ожоги. Смеси этиленоксида с воздухом взрывоопасны в широких концентрационных пределах —от 3 до 100%.
Этиленоксид используется для получения многих химических веществ и полупродуктов, в частности этиленгликолей, этаноламинов, полиэтиленоксидов, блок-сополимеров этиленоксидов и пропиленоксидов и т. д.
Этиленоксид также применяют в фармокологии.
Епиколопян С. Н., Вольфсон С. А. Химия и технология полиформальдегида. М., Химия, 1968. 279 с.
Кузнецов Е. В., Прохорова И. П. Альбом технологических схем производства полимеров и пластмасс на их основе. Изд. 2-е. М., Химия, 1975. 74 с.
Николаев А. Ф., Синтетические полимеры и пластические массы на их основе. Изд. 2-е. М. — Л., Химия, 1966. 768 с.
Справочник по пластическим массам. Изд. 2-е./Под ред. В. М. Катаева, В. А. Попова, Б. И. Сажина. М., Химия, 1975. т. I. 448 с.
Фурукава Дж., Саегуса Т. Полимеризация альдегидов и окисей. Пер. с англ./Под ред. Н. С. Ениколопяна. М., Мир, 1965. 479 с.
Автор: Коршак В.В.
Источник: Коршак В.В., Технологии пластических масс, 3-е издание, 1985 год
Дата в источнике: 1985 год
