Физиологически активные полимеры
Физиологически активные полимеры — это высокомолекулярные соединения, обладающие способностью влиять на физиологические процессы. Ответная физиологическая реакция может проявиться в изменении общего состояния организма или отдельных его биологических систем (клеток, тканей, жидкостей, органов). Это может быть результатом воздействия полимерного вещества непосредственно на специфические рецепторы, на мембраны или органеллы клеток, водно-солевой или гидрофильнолипофильный баланс жидкостей (кровь, лимфа), микробную флору, присутствующую в здоровом или инфицированном организме, и др. Физиологическую активность высокомолекулярных соединений стали активно изучать с конца 50-х гг. 20 в.
Как синонимы физиологической активности иногда употребляют термины биологическая активность и фармакологическая активность.
Физиологически активные полимеры можно классифицировать по источникам получения и по функциональной (физиологической) активности.
К природным физиологически активным полимерам (биополимерам) относятся белки, нуклеиновые кислоты, полисахариды, липопротеиды и другие высокомолекулярные продукты жизнедеятельности животных и растительных организмов (см. Биополимеры, Биополимеры смешанные). Физиологическую активность проявляют практически все природные высокомолекулярные соединения, когда они, будучи выделены из животных или растительных тканей одного организма, вводятся в другой организм.
Примеры природных физиологически активных полимеров: гамма-глобулин, гепарин, инсулин, протамины, нуклеазы, интерфероны и др.
Синтетические физиологически активные полимеры получают всеми методами синтеза высокомолекулярных соединений. К синтетическим ФАП относятся, в частности:
- поливиниловый спирт (ПВС),
- поли-N-винилпирролидон (ПВП),
- полиэтиленоксид (ПЭО),
- поливинилпиридиний-N-oксид,
- все производные, получаемые реакциями в цепях синтетических полимеров любого состава, например, сульфовинол (сульфированный ПВС) — аналог гепарина, йодинол (растворр комплекса йода с ПВС), полимерные производные анестетиков, противотуберкулезных, противоопухолевых и др. терапевтически активных соединений.
Полусинтетические физиологически активные полимеры — все полимерные производные, получаемые модификацией синтетических полимеров с использованием природных веществ различной молекулярной массы. Это, например, полимеры, к основным цепям которых присоединены алкалоиды, антибиотики, ферментные и гормональные препараты или др.
Искусственные физиологически активные полимеры включают полимеры, для получения которых используются биополимеры. Наиболее известны клинические декстраны и желатиноль (продукт частичного гидролиза декстрана или желатины), оксиэтилкрахмал (препарат крахмала, в котором гидроксильные группы частично замещены на оксиэтильные), производные декстрана — сульфодекстран, ферродекстран и др., а также производные целлюлозы, обладающие антимикробным, гемостатическим, обезболивающим и др. действием (см. Полимеры в медицине, Антимикробные волокна). Проведением реакций в цепях таких природных полимеров, как декстран, желатина, коллаген и др., синтезированы искусственные физиологически активные полимеры, обладающие лекарственными свойствами. Некоторые
Физиологически активные полимеры, полученные путем сочетания синтетических и природных полимеров, молекулярные массы которых достаточно близки, можно с одинаковым основанием отнести как к полусинтетическим, так и к искусственным.
По функциональной активности, то есть по свойствам, позволяющим использовать полимеры в медицине, ветеринарии и биологии, физиологически активные полимеры целесообразно разделить на:
- кровезаменители и плазмозаменители,
- лекарственные (фармакологически активные),
- вспомогательные полимеры.
Такое деление условно, так как из-за многообразия свойств некоторые из ФАП можно относить не к одной, а к нескольким группам. В ряде случаев принадлежность к той или иной группе определяется молекулярной массой полимера, его агрегатным состоянием, концентрацией раствора или даже способом его применения (наружно, инъекционно и др.). Например, ПВС используется для получения медицинских средств, входящих в каждую из перечисленных групп. Тем не менее такая классификация позволяет нагляднее сопоставлять свойства и структуры полимеров, проявляющих физиологическую активность.
Характер физиологической активности полимеров и ее эффективность определяются наличием реакционноспособных групп (или групп, обладающих определенным фармакологическим действием), величиной и структурой полимерной цепи. В ряде случаев физиологической активностью обладают полимеры, в составе которых нет каких-либо группировок, известных как фармакологически активные в виде низкомолекулярных соединений. Кроме того, полимеры, содержащие те или иные фармакологически активные группировки, обладают физиологической активностью, отличающейся от той, которую проявляют исходные соединения в виде мономеров, гидрированных мономеров или низкомолекулярных аналогов (димеры, тримеры, олигомеры).
В проявлении физиологической активности существенную роль играет способность полимерных веществ к комплементарным конформационным превращениям и кооперативному связыванию, к сорбционным, донорно-акцепторным, вандерваальсовым и гидрофобным взаимодействиям с природными макромолекулами, участвующими в обеспечении жизнедеятельности организма. Эти особенности обеспечивают количественно, а иногда и качественно новые (по сравнению с низкомолекулярными веществами) способы связывания полимеров с биологическими объектами (мембранами и компонентами клеток, биорецепторами и др.).
Большое значение имеют такие молекулярные характеристики, как:
- молекулярная масса,
- разветвленность,
- блочное или статистическое распределение функциональных групп,
- микротактичность.
Так, образцы поли-2-винилпиридний-N-оксида изотактической (спиральная конформация) и синдиотактической (плоская цепь) структур существенно различаются по противосиликозной активности, а соответствующие мономеры и олигомеры вообще не активны в этом отношении. На примере сернокислых эфиров ПВС и целлюлозы (линейные полимеры), крахмала и гликогена (разветвленные) показано, что с увеличением молекулярной массы от 40 до 150 тыс. и степени разветвленности макромолекул токсичность заметно повышается. Иногда токсичными оказываются олигомерные фракции (например, для сополимера винилпирролидона с кротоновым альдегидом). В некоторых случаях оптимально эффективны фракции полимеров в определенном интервале молекулярных масс, например, пираны в отношении интерфероногенного действия (см. табл. 1).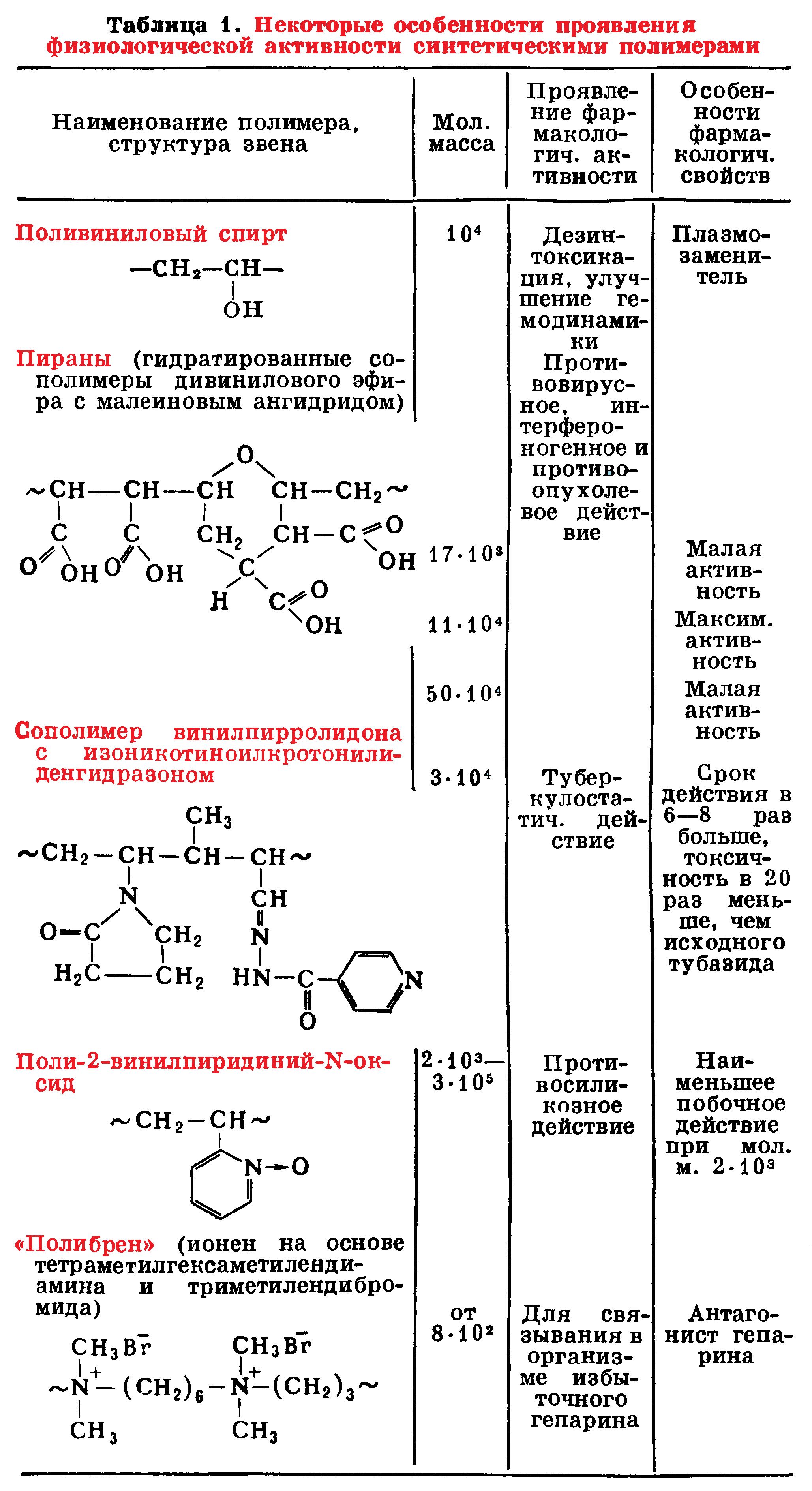
Необходимо установление для физиологически активных полимеров таких специфических свойств, как токсичность, совместимость с кровью (если полимер используется инъекционно), характер воздействия на иммунные и ферментные системы организма, а также других химико-биологических характеристик.
В зависимости от способа применения требования к физиологически активным полимерам могут существенно различаться. С точки зрения фармакологии и токсикологии ФАП должны удовлетворять тем же требованиям, что и обычные лекарственные средства. Основное из них — отсутствие токсичности. При введении в организм или контакте с тканями в условиях in vitro или in vivo вещество не должно оказывать повреждающего (токсического) действия на клетки, органы или организм в целом.
Следует, однако, отметить, что величина ЛД50 (доза, при введении которой погибает 50% подопытных животных), используемая для оценки токсичности обычных фармакологических препаратов, для характеристики физиологически активных полимеров весьма условна или вовсе не пригодна. Необходимое в таких опытах повышение содержания вещества в определенном объёме растворителя (воды) часто не может быть обеспечено из-за значительного нарастания вязкости раствора полимера и невозможности вследствие этого введения нужной дозы в организм подопытного животного. Поэтому при первичной характеристике токсичности физиологически активных полимеров часто ограничиваются установлением отсутствия повреждающего действия на организм средних терапевтических доз растворов полимеров или указывают предельную испытанную дозу в мг на 1 кг массы животного.
Как правило, при средних молекулярных массах (до 50—70 тыс.) подавляющее большинство полимеров практически не токсично. Это объясняется, вероятно, тем, что карбоцепные макромолекулы почти не метаболизируют и выводятся из организма в неизмененном виде. Существенно также, что при выделении и очистке ФАП, а также при создании полимерных лекарственных форм (растворов, пленок, гелей и др.) удаляются инициаторы полимеризации, мономеры и олигомеры, которые часто токсичны. Кроме того, поскольку эффективность и длительность нахождения ФАП в организме зависят от молекулярной массы, принимаются специальные меры (подбор условий полимеризации, фракционирование, диализ и т. д.) для получения фракций с достаточно узким молекулярно-массовым распределением.
Физиологически активные полимеры должны хорошо растворяться в воде и физиологическом растворе (0,9%-ный раствор NaCl в воде), без чего практически затруднено или невозможно испытание их токсико-биологических свойств и инъекционное, особенно внутривенное, применение.
Физиологическая активность свойственна и полимерам в массе. Особенно отчетливо это проявляется, когда их поверхность соприкасается с кровью или другими жидкостями организма. Наиболее известны тромбообразование и коагуляция форменных элементов крови в результате взаимодействия с поверхностями полимеров, введенных в организм в виде имплантатов (сосуды, пленки, нити). Эти взаимодействия очень разнообразны, и факторы, определяющие механизм тромбообразования, до конца еще не выяснены.
Некоторые из экспериментальных данных хорошо объясняются теорией электрохимического взаимодействия на поверхности раздела полимер — кровь. Однако проблема устранения тромбообразования не решена; изучаются различные аспекты биофизического взаимодействия инородной (полимерной) поверхности с кровью и возможности модификации поверхности с целью придания ей тромборезистентности. Так, полимеры, содержащие ионогенные группы, можно модифицировать обработкой природным полимерным антикоагулянтом — гепарином. Эффективен способ графитизации поверхности полимера. Показаны положительные антикоагуляционные свойства полиамфолитов и полимеров с химически связанными редкоземельными элементами (например, неодимом). С целью получения биосовместимых материалов испытано большое число полиэлектролитных комплексов — полисолей типа комплексов Михаэлиса (например, на основе полистиролсульфоната натрия и поливинилбензилтриметиламмонийхлорида). Некоторые из полимерных гидрогелей ионного и нейтрального характера не вызывают образования тромбов, но обладают заметной токсичностью, вследствие чего использование их невозможно.
Изучаются и применяются полимеры в массе (пленки, волокна, тканые материалы, вата и др.), обладающие антимикробной, гемостатической, анестетической и др. типами физиологической активности (см. Медицинские нити, Полимеры в медицине).
В качестве имплантатов (внутренних протезов) используют полимеры биоинертные, т. е. не подвергающиеся быстрой деструкции в организме. Однако свойства биосовместимости и биоинертности должны проверяться очень тщательно в длительных экспериментах, так как ферментные и защитные системы организма, хотя и медленно, но разрушают введенные в него полимеры (скорость биодеструкции зависит как от структуры, так и от молекулярной массы). При этом полимер может деструктироваться до олигомеров или низкомолекулярных соединений, обладающих физиологии, активностью и даже токсическим действием.
Так, пластинки из поливинилкапролактама с молекулярной массой 40 тыс. покрываются в организме капсулой из соединительной ткани (инкапсулируются) и практически не рассасываются; полимер с молекулярной массой 13—18 тыс. разрыхляется, затем деструктируется на фрагменты и рассасывается, причем продукты его метаболизма (превращения) оказывают токсичное действие на органы, ответственные за выведение веществ из организма (печень, почки). Таким образом, влияние молекулярных характеристик, химических и физических свойств на физиологическую активность не однозначно; последняя зависит также от механизма действия полимера в организме.
Лекарственные полимеры
Лекарственные полимеры — это высокомолекулярные соединения, которые благодаря особенностям состава, строения, свойств могут быть использованы в качестве терапевтических или других средств в лечебной медицинской практике или в медицинском (физиологическом) эксперименте. Как и низкомолекулярные лекарственные средства, полимерные препараты следует классифицировать по их основному фармакологическому действию: анестезирующие (обезболивающие), антикоагуляционные и др.
Число синтетических полимеров, нашедших практическое применение, относительно невелико, если не считать кровезаменители. Однако изучению в экспериментах на животных и проверке в клинических условиях подвергается большое число фармакологически активных полимеров, особенности свойств которых указывают на большую перспективность последующего использования их.
Любое лекарственное соединение на пути от места введения до места воздействия (например, рецептор органа, микробный или вирусный возбудитель, инфицирующий организм) проходит ряд стадий.
Основные из них:
- всасывание,
- распределение с кровью или лимфой по органам,
- взаимодействие с рецепторами или клетками организма,
- метаболизм,
- выведение через выделительные системы.
Поведение низко- и высокомолекулярных веществ на каждой из этих стадий существенно различно.
Переводом в полимерное состояние обычных лекарственных веществ можно добиться существенного изменения ряда их свойств:
- увеличить длительность действия (эффект пролонгирования, создания «депо»), что обусловлено замедленным поглощением лекарства из места введения и замедленным выведением его из организма;
- расширить диапазон допустимой дозы (уменьшение токсичности) и улучшить растворимость;
- изменить фармакокинетику (зависит от скорости освобождения активного компонента из полимерной структуры, молекулярной массы, структуры полимера и свойств, включенных в него сомономеров, путей метаболизма);
- изменить распределение в организме, что определяется связыванием g белками, всасыванием, взаимодействием с клеточными мембранами и внутриклеточными элементами;
- обеспечить проявление специфического полимерного эффекта (в том числе кооперативного взаимодействия с находящимися в организме белками, нуклеиновыми кислотами и др.);
- добиться комбинированного действия нескольких лекарственных веществ, присоединенных к одной и той же полимерной цепи.
Установлено также, что ряд полимеров, не содержащих специально введенных в их структуру терапевтически активных группировок, обладает фармакологической активностью, позволяющей использовать их в качестве лечебных препаратов (см. табл. 1, а также Полимеры в медицине).
Наиболее широко развиваются исследования в области синтеза лекарственных полимеров включением в полимерные структуры фармакологически активных веществ или их аналогов. Для этого используются все методы химии высокомолекулярных соединений, главным образом полимераналогичные превращения, а также полимеризация (сополимеризация) мономеров — чаще всего виниловых соединений, содержащих остаток акриловой, метакриловой или кротоновой кислот. Успешно испытываются полимерные производные антибиотиков, антимикробных, противотуберкулезных, противоопухолевых, противовоспалительных и др. лекарственных веществ.
В качестве полимерной основы, кроме синтетических, используют также природные полимеры или их производные (окисленные, этерифицированные и др.), например, целлюлозу, декстран, коллаген, белки, нуклеиновые кислоты. На основе декстрана и целлюлозы получены препараты с антимикробным, гемостатическим, противотуберкулезным, обезболивающим и другими свойствами.
У лекарственного полимера, полученного включением в его структуру известного терапевтически активного соединения, основные свойства последнего, как правило, сохраняются. Однако полимерная природа такого производного может существенно изменить характер (механизм) действия этого активного соединения. Так, мономер — N-метакрилоилфенамин (МФА)
СН2=С (СН3)—СО—NH—СН (СН3)СН2С6Н5
действует на дыхательный центр, как и известное лекарственное средство фенамин
NH2—СН(СН3)—СН2—С6Н5, из которого он получен.
Сополимер МФА с метакриловой кислотой проявляет несколько более сильный эффект учащения дыхания, чем фенамин, а сополимеры МФА с винилацетатом или N-винилпирролидоном обладают противоположным действием — вызывают урежение дыхания. По гипертезивному действию (увеличение давления крови) перечисленные вещества примерно одинаковы. Все полимерные производные фенамина значительно менее токсичны, чем фенамин.
Возможность использования некоторых полимеров в качестве лекарственных средств обеспечивается главным образом не их химическими свойствами, а специфичным сочетанием физических свойств. Так, применение в медицине и ветеринарии полиорганосилоксанов обусловлено их гидрофобным, антиадгезивным, антивспенивающим действием.
На практике они применяются при лечении язвы желудка, расстройств пищеварения, отека легких (использование пеногасящего действия) и других заболеваний.
Путем создания специальных структур полимеров, содержащих функциональные группы различного характера, можно получить лекарственные средства для инъекционного, наружного и внутреннего употреблений.
Вспомогательные полимеры
Вспомогательные полимеры при совместном использовании с лекарственными веществами влияют на динамику, длительность, интенсивность их действия без существенного изменения основных функций в организме. Для этой цели могут быть использованы полимеры-плазмозаменители, водорастворимые сополимеры винилпирролидона, винилового спирта, модифицированные декстраны, карбоксиметилцелллоза, полиэтиленгликоль и др. Они служат солюбилизаторами, поверхностно-активными веществами, комплексообразователями и др. Например, в присутствии ПВС, ПВП, декстрана, полиэтиленоксида и др. растворяется ряд лекарственных веществ, не растворимых в воде или физиологическом растворе. Применение концентрированных растворов полимеров, гелей, порошков и пленок с введенными в них лекарственными веществами позволяет изменить способы введения лекарства в организм (получить новые лекарственные формы), удлинить сроки действия, снизить токсичность. Знание времени рассасывания (растворения) гелей, пленок, нитей позволяет создать «депо», из которых лекарственное вещество выделяется с рассчитанной скоростью, причем концентрация лекарства поддерживается на нужном уровне.
К вспомогательным полимерам (так называемым, полимерам-носителям или пролонгаторам) можно отнести и большую группу высокомолекулярных соединений, используемых для получения лекарственных полимеров. Чаще всего применяют водорастворимые полимеры, содержащие группы —ОН, —СООН, —СHO, —COСI, —NH2, —CONH2, ангидридные, изоциатные и др.
Физиологически активные полимеры, у которых фармакологически активные группы связаны с полимерной структурой химическими связями, следует рассматривать без деления на полимер-носитель и лекарственное вещество. Даже если в организме происходит отщепление «лекарственной группы», поведение и функции полимерной основы могут быть иными, чем у исходного носителя. Роль носителя или пролонгатора не является пассивной и в случаях простых композиций.
При применении лекарств в смеси с полимерами (в виде растворов, гелей, суспензий и др.) заметного фармакологического действия собственно полимера практически не наблюдается и его можно считать биоинертным. Однако физиологическая активность полимера не проявляется из-за того, что незначительны его абсолютные количества (дозы), или она незаметна на фоне действия основного лекарственного вещества.
Установлено, что природа полимерной цепи существенно влияет на проявление действия лекарственного вещества, используемого в смеси с раствором полимера. Так, плазмозаменители декстран и поливинилпирролидон в смеси с гепарином не оказывают заметного действия на свертывание крови по сравнению с физиологическим раствором, содержащим гепарин. Смесь же гепарина с раствором поливинилового спирта дает выраженное замедление свертывания.
Создание смесей полимеров (или их концентрированных растворов) с лекарственными веществами различной природы приводит к получению эффективных лечебных средств для внутреннего (таблетки, капсулы, растворы) и наружного (мази, растворы, аэрозоли, пленки) применения. При этом в ряде случаев физиологическая активность полимеров проявляется в активизации процессов всасывания и проникновения лекарственных средств через слизистые оболочки, кожу и др.
В фармацевтической практике полимеры широко используют как основу мазей, таблеток или покрытий (см. Полимеры в фармокологии). В качестве гидрофобизаторов применяют различные нетоксичные кремнийорганические полимеры. Накоплено много экспериментальных данных о биологической (физиологической) активности полимеров, об их влиянии на активность и сроки действия ряда фармакологических препаратов при совместном применении, а также об особенностях свойств лекарственных веществ, ковалентно связанных с полимерами.
Читайте также:
Разводовский Е.Ф., Синтетические полимеры в фармакологии, в кн.: Успехи химии и физики полимеров, М., 1973, с. 302;
Илиев И., Георгиева М., Кабаиванов В., Усп. хим., 43, № 1, 134 (1974);
КропачевВ. А., Полимеры как носители лекарственных функций, в кн.: Пленарные доклады 3-го симпозиума по физиологически активным синтетическим полимерам и макромолекулярным моделям биополимеров, Рига, 1973;
Кренцель Б. А., Физиологическая активность и полимерное состояние вещества, там же, с. 13;
Хомяков К. П., Вирник А. Д., Роговин 3. А., Пролонгирование действия лекарственных препаратов путем использования их в смеси с полимерами или присоединения к полимерам, Усп. хим., 33, № 9, 1051 A964);
Воронков М. Г., Зелчан Г. И., Лукевиц Э. Я., Кремний и жизнь, Рига, 1971, с. 227; Мохнач В. О., Йод и проблемы жизни, Л., 1974;
Бойд У., Основы иммунологии, пер. с англ., М., 1969, с. 105;
Вирник А. Д., Хомяков К. П., Скокова И. Ф., Усп. хим., 44, в. 7, 1280 A975);
Кровезаменители, под ред. А. Н. Филатова, Л., 1975;
Ringsdorf Н., J. Polymer Sci.: Polymer symposia, № 51, 135 A975); Polyelectrolytes and their applications, v. 2, Boston, 1975.
Автор:
В. А. Кропачев,
3. А. Чаплыгина.
Источник: Энциклопедия полимеров, том 3,с.735
Дата в источнике: 1974 год
