Оксиды
Оксиды – это соединения, образованные атомами двух элементов, одним из которых является кислород в степени окисления (-2).
К оксидам относятся все соединения элементов с кислородом, например Fe2O3, P4O10, кроме содержащих атомы кислорода, связанные химической связью друг с другом:
и соединения фтора с кислородом (OF2, O2F2), которые следует назвать не оксидами фтора, а фторидами кислорода, так как степень окисления кислорода в них положительная.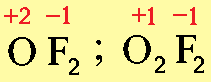
Физические свойства оксидов
Температуры плавления и кипения оксидов меняются в очень широком интервале. При комнатной температуре они, в зависимости от типа кристаллической решетки, могут находиться в различных агрегатных состояниях. Это определяется природой химической связи в оксидах, которая может быть ионной или ковалентной полярной.
В газообразном и жидком состояниях при комнатной температуре находятся оксиды, образующие молекулярные кристаллические решетки. С увеличением полярности молекул температуры плавления и кипения повышаются (таблица 1).
Таблица 1: Температуры плавления и кипения некоторых оксидов (при давлении 101,3 кПа)
| CO2 | CO | SO2 | ClO2 | SO2 | Cl2O7 | H2O | |
| Tплавления,⁰C | -78 (Tвозгонки) | -205 | -75,46 | -59 | -16,8 | -93,4 | 0 |
| Tкипения, ⁰C | -191,5 | -10,1 | 9,7 | 44,8 | 87 | 100 |
Оксиды, образующие ионные кристаллические решетки, например, CaO, BaO и другие являются твердыми веществами, имеющими очень высокие температуры плавления (>1000⁰C)/
В некоторых оксидах связи ковалентные полярные. Они образуют кристаллические решетки, где атомы связаны несколькими «мостиковыми» атомами кислорода, образуя бесконечную трехмерную сеть, например, Al2O3, SiO2, TiO2, BeO и эти оксиды тоже имеют очень высокие температуры плавления.
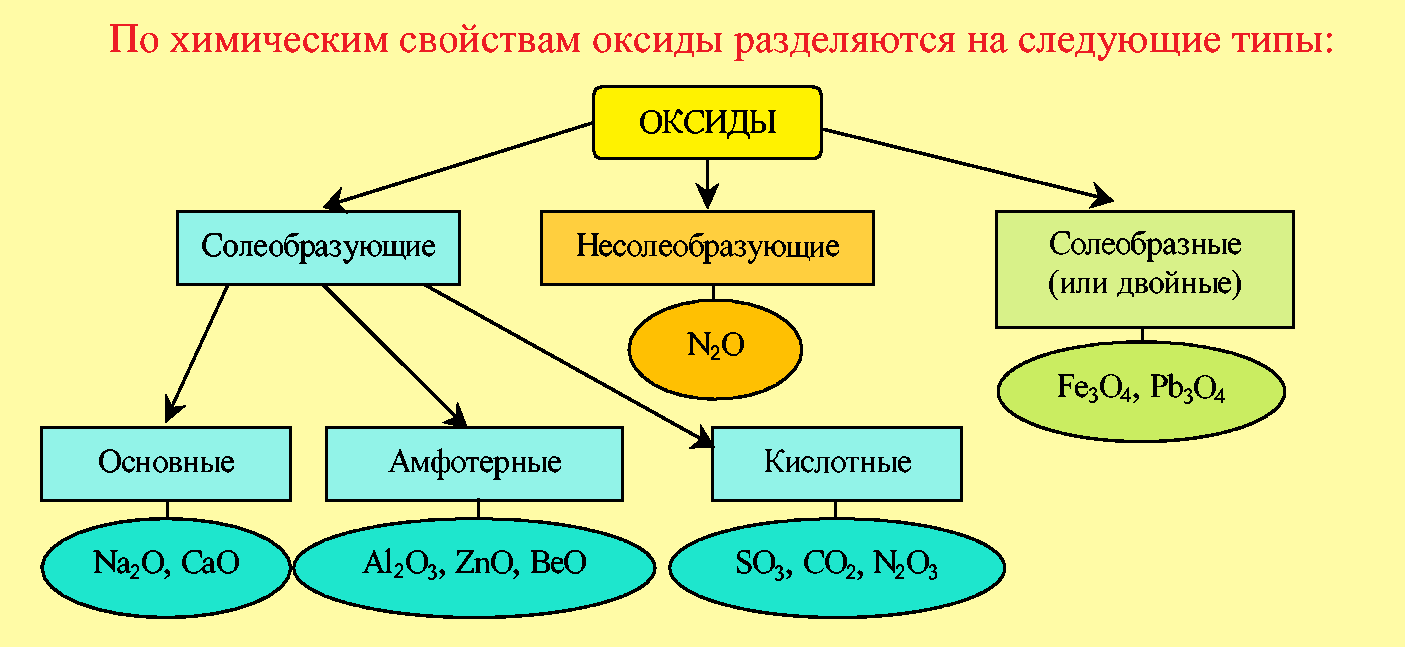
Классификация оксидов по химическим свойствами
Несолеобразующие оксиды – оксиды, которым не соответствуют ни кислоты, ни основания.
Солеобразные оксиды – это двойные оксиды, в состав которых входят атомы одного металла в разных степенях окисления.
Металлы, проявляющие в соединениях несколько степеней окисления, образуют двойные, или солеобразные оксиды. Например, Pb3O4, Fe3O4, Mn3O4 (формулы этих оксидов могут быть записаны также в виде 2PO·PbO2, FeO·Fe2O3, MnO·Mn2O3 соответственно).
Например, Fe3O4→FeO·FeO3: представляет собой основной оксид FeO химически связанный с амфотерным оксидом Fe2O3, который в данном случае проявляет свойства кислотного оксида. И Fe3O4 формально можно рассматривать как соль, образованную основанием Fe(OH)2 и кислотой [HFeO2], которая не существует в природе: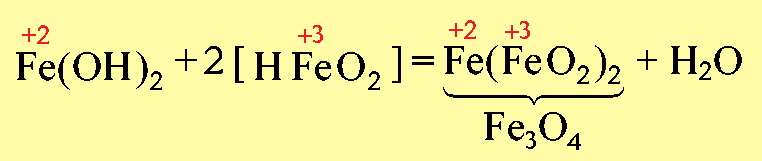
От гидрата оксида свинца (IV), как от кислоты, и Pb(OH2), как основания, могут быть получены два двойных оксида Pb2O3, Pb3O4(сурик), которые можно рассматривать как соли. Первый является свинцовой солью метасвинцовой кислоты (H2PbO3), а второй – ортосвинцовой кислоты (H4PbO4).
Среди оксидов, особенно среди оксидов d—элементов, много соединений переменного состава (бертолиды), содержание кислорода в которых не соответствует стехиометрическому составу, а изменяется в довольно широких пределах, например, состав оксида титана (II) TiO изменяется в пределах TiO0,65 — TiO1,25.
Солеобразующие оксиды – это оксиды, которые образуют соли. Оксиды этого типа делятся на три класса: основные, амфотерные и кислотные.
Основные оксиды – оксиды, элемент которых при образовании соли или основания становится катионом.
Кислотные оксиды — это оксиды, элемент которых при образовании соли или кислоты входит в состав аниона.
Амфотерные оксиды – это оксиды, которые в зависимости от условий реакции могут проявлять как свойства кислотных, так и свойства основных оксидов.
При образовании солей степени окисления элементов, образующих оксиды, не изменяются, например: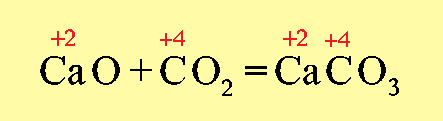
Если при образовании соли происходит изменение степеней окисления элементов, образующих оксиды, то получившуюся соль следует отнести к соли другой кислоты или другого основания, например: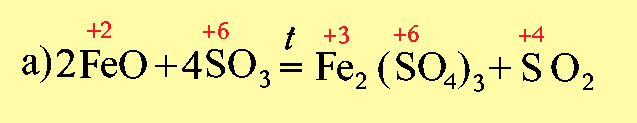
Fe2(SO4)3 представляет собой соль, образованную серной кислотой и гидроксидом железа (III)- Fe(OH)3, которому соответствует оксид Fe2O3.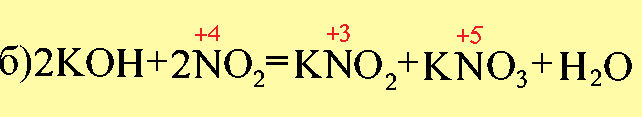
Образовавшиеся соли являются солями азотистой (H+3NO2) и азотной (H+5NO3) кислот, которым соответствуют оксиды: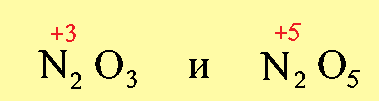
Закономерности изменения свойств оксидов
Увеличение степени окисления и уменьшение радиуса его иона (при этом происходит уменьшение эффективного отрицательного заряда на атоме кислорода –δ0) делают оксид более кислотным. Это и объясняет закономерное изменение свойств оксидов от основных к амфотерным и далее к кислотным.
А) В одном периоде при увеличении порядкового номера происходит усиление кислотных свойств оксидов и увеличение силы соответствующих им кислот.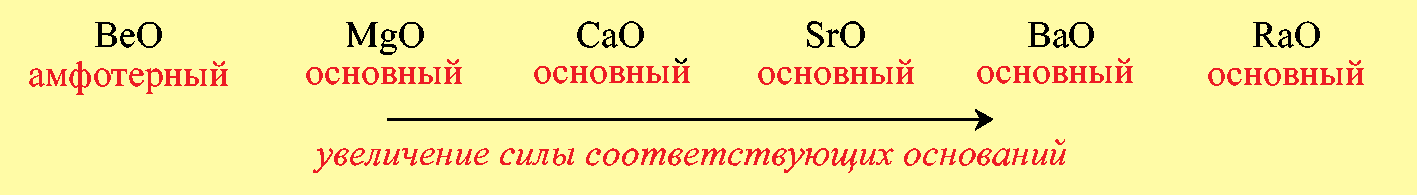
Таблица 2: Зависимость кислотно-основных свойств оксидов от эффективного заряда на атоме кислорода
| Оксид | Na2O | MgO | Al2O3 | SiO2 | P4O1023 | SO3 | Cl2O7 |
| Эффективный заряд δ0 | -0,81 | -0,42 | -0,31 | -0,23 | -0,13 | -0,06 | -0,01 |
| Кислотно- основные свойства оксида | Основный | Основный | Амфотерный | Кислотный | |||
Б)В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов: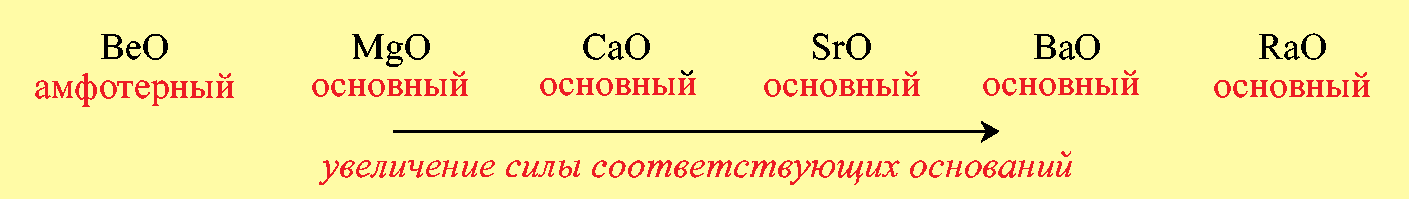
В)При повышении степени окисления элемента усиливаются кислотные свойства оксидов и ослабевают основные:
Таблица 3: Зависимость кислотно-основных свойств от степени окисления металлов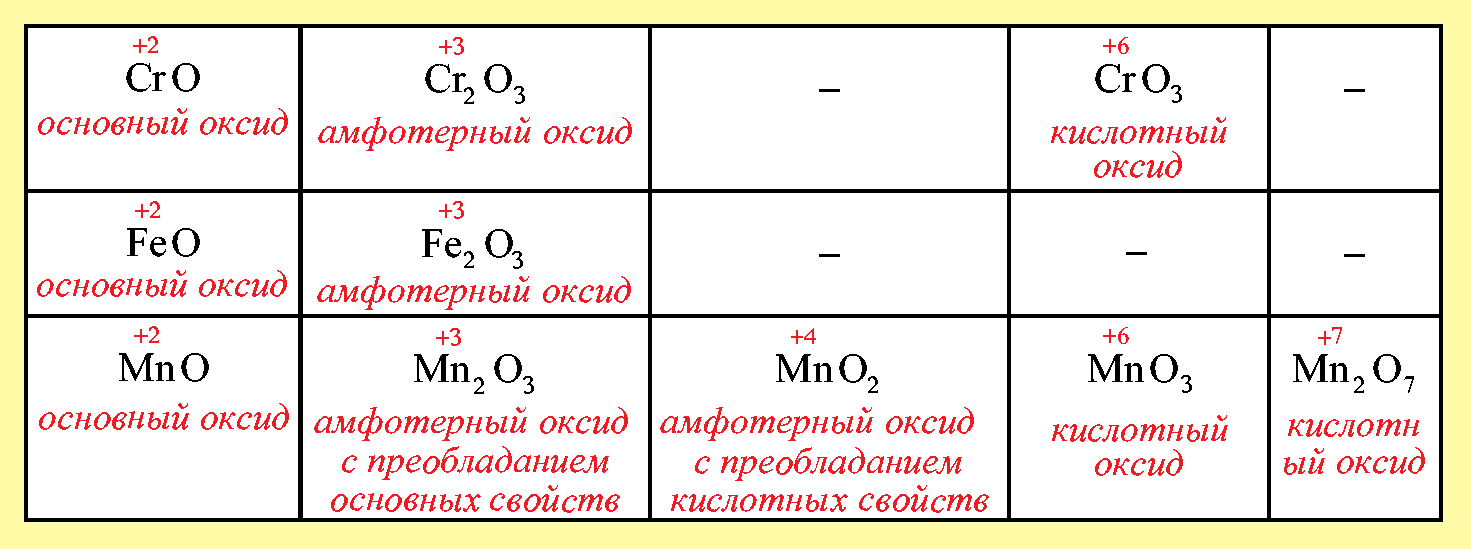
Автор: Ю. М. Коренев
Источник: Общая и неорганическая химия, Ю. М. Коренев, В. П. Овчаренко, 2000г
Дата в источнике: 2000 год