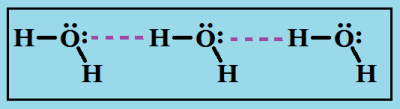Водородные связи
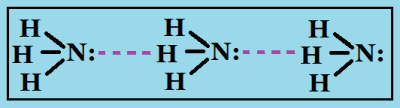
Водородные связи являются более прочным видом межмолекулярного взаимодействия, по сравнению с диполь-дипольным или дисперсионным взаимодействием. Энергии водородных связей находятся в пределах 5-10 ккал/моль. Водородные связи образуются между функциональными группами, содержащими «кислые» протоны (т.е. протоны OH- и NH-групп), и атомами, имеющими неподеленные электронные пары.
Классический пример сильных водородных связей между молекулами воды:
Менее прочные водородные связи образуются в аммиаке:
Водородные связи полностью отсутствуют в метане. Именно поэтому эти три простейшие органические соединения, обладая почти одинаковой молекулярной массой, сильно различаются по температурам кипения:
| Соединение | CH4 (метан) | NH3 (аммиак) | H2O (вода) |
| Температура кипения,⁰C | -160 | -33 | 100 |
Вернуться к статье Межмолекулярные взаимодействия в органических соединениях
Автор: Травень В.Ф.
Источник: Органическая химия: Учебник для ВУЗов, Травень В.Ф., Москва, Академкнига, 2004 год
Дата в источнике: 2004 год