Карбамид (мочевина)
 В чистом виде карбамид представляет собой кристаллы в форме игл или плоских призм с температурой плавления около 133 °С, хорошо растворимые в воде и хуже — в спирте. Карбамид является диамидом угольной кислоты.
В чистом виде карбамид представляет собой кристаллы в форме игл или плоских призм с температурой плавления около 133 °С, хорошо растворимые в воде и хуже — в спирте. Карбамид является диамидом угольной кислоты.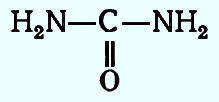 Хотя в некоторых реакциях все атомы водорода при азоте могут быть замещены, при образовании карбамидоформальдегидных полимеров карбамид является трифункциональным, а не тетрафункциональным соединением. Поэтому карбамид правильнее рассматривать как амид карбаминовой кислоты.
Хотя в некоторых реакциях все атомы водорода при азоте могут быть замещены, при образовании карбамидоформальдегидных полимеров карбамид является трифункциональным, а не тетрафункциональным соединением. Поэтому карбамид правильнее рассматривать как амид карбаминовой кислоты.
Предполагается, что карбамид вступает в химические реакции в таутомерной форме, в которой имеются две различные азотосодержащие группы.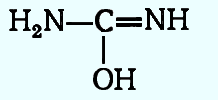 Карбамид является слабым основанием (рKа в водном растворе 0,18), способным образовывать соли как с неорганическими (азотная, серная, соляная), так и с органическими (муравьиная, уксусная, пропионовая) кислотами.
Карбамид является слабым основанием (рKа в водном растворе 0,18), способным образовывать соли как с неорганическими (азотная, серная, соляная), так и с органическими (муравьиная, уксусная, пропионовая) кислотами.
Промышленные методы получения карбамида основаны на взаимодействии аммиака с диоксидом углерода. 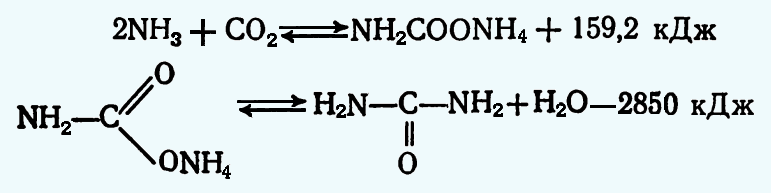
Вначале образуется карбамат аммония, который будучи крайне нестойким соединением, уже при 60—70 °С начинает разлагаться с выделением исходных продуктов. Поэтому процесс ведут при давлении 20 МПа. Затем происходит дегидратация карбамата, которая протекает с достаточной скоростью только в жидкой фазе, т. е. когда образующийся карбамат находится в расплаве (т. пл. 145 °С). Для смещения равновесия в сторону образования карбамида в реакцию вводят избыточное количество аммиака (около 200% от теоретического) .
Брацыхин Е. Л. Технология пластических масс. 2-е изд. М. — Л., Химия, 1974. 350 с.
Лосев И. П., Тростянская Е. Б. Химия синтетических полимеров. 3-е изд. М., Химия, 1971. 615 с.
Стрепихеев А. А., Деревицкая В. А., Слонимский Г. Л. Основы химии высокомолекулярных соединений. 2-е изд. М., Химия, 1966. 515 с.
Николаев А. Ф. Технология пластических масс. Л., Химия, 1977. 366 с.
Автор: Коршак В.В.,
Источник:
Энциклопедия полимеров,1 том под ред. Каргина В.А.
Коршак В.В., Технологии пластических масс, 3-е издание, 1985 год
Дата в источнике: 1985 год
